NEURELEC Digisonic SP EVO User manual

1
EN - Instructions for use, pages 2 to 9.
FR - Instructions d’utilisation, pages 10 à 17.
DE - Bedienungsanweisungen, Seiten 18 bis 25.
IT - Istruzioni per l’uso, pagine da 26 a 33.
ES - Instrucciones de funcionamiento, páginas 34 a 41.
SK - Návod na použitie, strany 42 až 49.
PL - Instrukcja użytkowania, strony od 50 do 57.
PT - Instruções de utilização, páginas 58 a 65.
RO - Instrucţiuni de utilizare, paginile 66 până la 73.
NL - Gebruiksinstructies, pagina’s 74 tot 81.
TR - Kullanım talimatları, sayfa 82 ila 89.
ΕΛ - Οδηγίες χρήσης, σελίδες 90 έως 97.
RU - Инструкции по применению, стр. 98 - 105.

2
CONTENTS
1. DESCRIPTION OF THE DEVICE ...............................................................................................3
Model name........................................................................................................................3
Commercial identication...................................................................................................3
Device description..............................................................................................................3
2. PACKAGE CONTENTS...............................................................................................................3
3. LIST OF COMPATIBLE ACCESSORIES....................................................................................3
4. SYMBOLS AND MEANINGS......................................................................................................3
5. INDICATIONS..............................................................................................................................3
6. MEDICAL CONTRAINDICATIONS.............................................................................................4
7. UNDESIRABLE SIDE EFFECTS................................................................................................4
8. WARNINGS FOR USE ................................................................................................................4
9. CAUTION, INTERACTION WITH TREATEMENT AND CLINICAL INVESTIGATIONS..............5
Caution ...............................................................................................................................5
High-voltage electrical eld................................................................................................5
Electrotherapy ..............................................................................................................5
Electrosurgery..............................................................................................................5
Electroshock therapy and debrillation........................................................................5
Medical diathermy..............................................................................................................5
Diagnostic tests or treatments using ultrasound................................................................5
Ionizing radiation therapy...................................................................................................5
Non-ionizing electromagnetic radiation .............................................................................5
MRI (Magnetic Resonance Imaging ............................................................................5
10. INSTRUCTIONS FOR USE.......................................................................................................6
Electrosurgery ....................................................................................................................6
Preoperative management .................................................................................................6
Intraoperative management ...............................................................................................6
Determining the location of the incision and the position of the receiver ....................6
Handling the implant....................................................................................................6
Orientation of the implant.............................................................................................6
Fixation of the implant .................................................................................................7
Inserting the electrode-array........................................................................................7
Positioning the reference electrode .............................................................................7
Conrming the implant is functioning...........................................................................7
11. EXPLANTATION .......................................................................................................................7
12.TECHNICAL SPECIFICATIONS OF THE DIGISONIC®SP EVO IMPLANT .............................8
13. PERFORMANCE CHARACTERISTICS ...................................................................................8
14. SPECIFICATIONS AND CHARACTERISTICS OF THE ELECTRODE-ARRAY ......................8
3
1. DESCRIPTION OF THE DEVICE
• Model name
Digisonic®SP EVO cochlear implant
• Commercial identication
I-SP-SD-EVO
• Device description
The Digisonic®SP EVO is a multi-channel cochlear implant designed to rehabilitate patients with severe
(2nd degree) to profound bilateral perceptive hearing loss. This cochlear implant works in conjunction with
a behind-the-ear external processor (DIGI SP/ SAPHYR® SP/ZEBRA/DIGI SP’K). Electromagnetic induction
between an external antenna and an internal one transmits the acoustic signal processed by the processor to
the Digisonic®SP EVO receiver implanted under the skin just behind the auricle of the ear.
The Digisonic® SP EVO includes an electrode array containing 20 electrodes. This array is inserted into the
implanted cochlea. Each individual electrode stimulates dierent groups of auditory nerve bers and each
corresponds to a dierent frequency band. The implant and the external antenna contain magnets that hold
them in the proper relative position for optimal performance. The Digisonic®SP EVO does not contain a power
source and only receives power when the external antenna is in place. If the external antenna is not present,
theDigisonic®SP EVO is not powered and does not work.
2. PACKAGE CONTENTS
1 Digisonic® SP EVO (I-SP-SD-EVO) implant, 1 implant template made of silicon, 1 xation system, 1 identication
card and accompanying documentation.
3. LIST OF COMPATIBLE ACCESSORIES
The implant is supplied with the following accessories:
• 1 silicone implant template used during the surgery to verify the correct positioning of the implant under
the skin.
• 2 self-tapping screws used to x the implant into position; these do not require any pre-drilling.
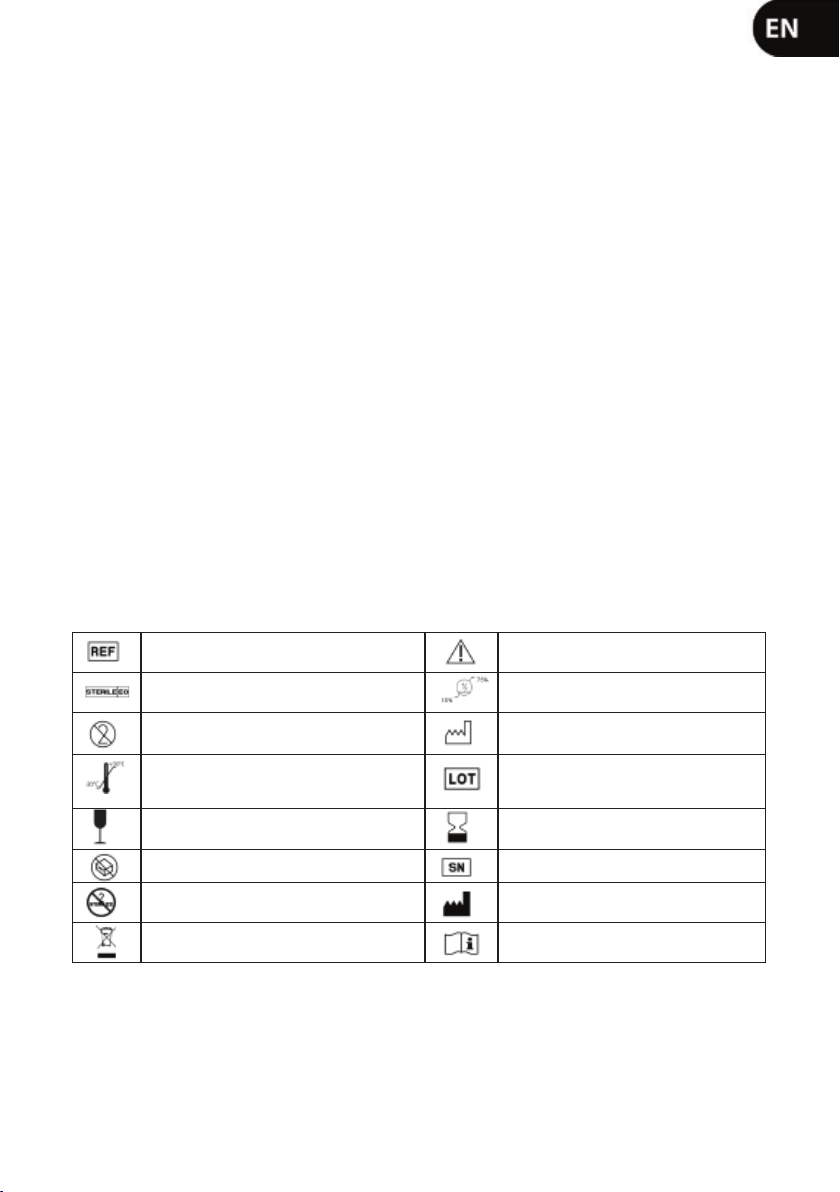
4. SYMBOLS AND MEANINGS
Catalog reference Important. Read the accompanying
documentation
Sterilization method: ethylene oxide
Sterile product Maintain humidity level between 15%
and 75%.
Single-use device, do not reuse Date of manufacture
STORAGE condition: store in a cool dry
place. Storage temperature between -20°
C and +50° C. Batch code
Fragile; handle with care Expiration date
Do not use if the package is damaged Serial number
Do not re-sterilize Manufacturer
Waste electrical and electronic equipment
(WEEE) Instructions for use
5. INDICATIONS
The multi-channel Digisonic®SP EVO cochlear implant is designed to rehabilitate patients who have 2nd degree
severe to total bilateral hearing loss with a speech intelligibility level of less than 50% at 60 dB HL in open-set
format with the use of a hearing aid (professional medical opinion required).

4
6. MEDICAL CONTRAINDICATIONS
The Digisonic®SP EVO cochlear implant is not indicated in patients with perceptive hearing loss accompanied
by large lesions in the cochlea (major cochlear malformation, fracture of the petrous pyramid, signicant
ossication of the cochlea), the auditory nerve (axonal neuropathy, tumor near or on the auditory nerve such as
an acoustic neuroma, complete destruction of both auditory nerves), a severe anomaly of the auditory pathways,
acute or chronic middle ear conditions (including tympanic membrane perforation), is psychologically unstable
or has a contact allergy to implant materials (silicone, platinum iridium, titanium). Other types of implants may
be recommended.
7. UNDESIRABLE SIDE EFFECTS
For patients who meet the indications for implantation must accept typical risks associated with surgery
(eectsfrom general anesthesia, infections, etc.) which is independent of any product. However, there is also
arisk that the patient’s body may reject the implant or a part of the implant. This risk has been reduced by using
biocompatible materials in the design.
Complications associated with the cochlear implant surgery (temporary or permanent facial paralysis, risk of
meningitis, changes in taste, dizziness, tinnitus, etc.) is rare, but should be considered carefully. It is important
to inform every prospective implant candidate about these potential risks. Specic information should be given
to the patient regarding the symptoms and the initial signs of meningitis. According to current recommendations,
pneumococcal vaccination is also strongly recommended.
Once the implant is in place, there remain certain risks that may result in explantation. Explantation require
additional surgical intervention under general anesthesia. Explantation may occur in the following cases:
- Medical complication
- Implant malfunction
- Displacement of the device as a result of trauma
- Extrusion of the implant
These postential problems were evaluated during product design and the materials and design of the implant
have been chosen to minimize these risks.
Finally, the long-term eects from trauma associated with the insertion of electrodes and chronic electrical
stimulation are unknown at the present time. These eects may include ossication of the cochlea or degeneration
of the nerve bers, and may require replacement of the implant or lead to a reduced response to stimulation.
8. WARNINGS FOR USE
Information to provide to the Patient:
- The patient should be informed of the benets of a cochlear implant, but also of its possible undesirable side
eects (see §7).
- The supplied identication card must be completed.
- Inform the patient that they must present the identication card prior to any medical examination or treatment.
- Advise the patient to carefully read the user instructions supplied with his/her external processor, in particular
the section relating to the warnings for use.
- In case of failure or malfunction of the cochlear implant system, the patient should contact his/her implantation
center.
- Contact sports (rugby, boxing, etc.) are strongly discouraged, since strong impacts to the area can damage
the implant.

5
- Scuba diving: Recreational scuba diving is not recommended at depths below 20m. Excess pressure can
damage the implant. Moreover, it is strongly discouraged to engage in professional deep-sea diving activities.
The implant is not guaranteed against repeated high pressure stresses.
- Access to restricted areas: Please consult a physician before entering restricted areas (MRI exam room,
walk-through metal detectors, 3D scanning booths, etc.).
9. CAUTION, INTERACTION WITH TREATEMENT AND CLINICAL INVESTIGATIONS
- Caution: Implantable device parts should not be reused if they have been previously implanted in another
patient.
- High-voltage electrical eld:
- Electrotherapy: Electrotherapy may send currents of varying strengths. The use of high-voltage
electrotherapy techniques is prohibited due to the risk of damage to the implant system. However, low-voltage
electrotherapy may be considered only if the electrodes are not placed in areas near the head or neck.
- Electrosurgery: Avoid the use of monopolar electrosurgical instruments. These instruments can create
radio-frequency elds through electrical charges that could cause the tip of the instrument and the electrode-
array to interact. Generated currents might damage the cochlear tissue or result in permanent damage to the
implant. As soon as a cochlear implant is removed from its packaging in the operating room, any monopolar
surgical systems should be turned o to avoid any damage to the implant. However, bipolar electrosurgical
systems can be used as long as it is not near to and does not come into direct contact with the cochlear
implant.
- Electroshock therapy and debrillation: Transmitting electrical shocks of several thousand volts through
the body is not advised in a patient wearing a cochlear implant. Electrical shocks can cause tissue damage
in the cochlea or permanently damage the implant.
In a life-threatening situation, only the medical team is in a position to make a decision. If the situation is not
life-threatening for the patient, please contact Neurelec
- Medical diathermy: Electromagnetic diathermy cannot be used on patients with implants containing metal.
This may cause irreparable damage to tissue (burning of the cochlea) or the implant. However, ultrasonic
diathermy may be considered on areas of the body that do not touch the head or neck.
- Diagnostic tests or treatments using ultrasound: The implant should not be exposed to therapeutic levels
ofultrasonic energy. The device may inadvertently concentrate the ultrasonic eld and be damaged.
- Ionizing radiation therapy: During radiation therapy sessions, we strongly advise against direct irradiation
ofthe implant zone. Direct, massive exposure of the implant to the rays could lead to partial or total loss ofimplant
functions. This damage is not necessarily immediately noticeable.
- Non-ionizing electromagnetic radiation:
- MRI (Magnetic Resonance Imaging) : The Digisonic®SP EVO implant contains a permanent magnet.
AnMRI exam or a strong magnetic eld applied near the implant may cause damage to the implant and/or the
patient. It is however possible to perform an MRI exam at 1.5 Tesla if recommendations are followed. In this
case, the radiologist should ll out an exam form, which is available at www.neurelec.com.
Refer to the processor’s user manual for more information.

6
10. INSTRUCTIONS FOR USE
Please note!
Electrosurgery: Once the implant is put into place, the rest of the surgical procedure should not include
theuse of any monopolar electrosurgical instruments. These instruments can create radio-frequency elds by
generating electrical charges that could damage the implant. Bipolar electrosurgical instruments can be used
as long as they are not used near nor do come into contact with the cochlear implant.
Preoperative management
- Before implanting the Digisonic® SP EVO for the rst time, the surgeon should become familiar with the particular
technical speci cations of the Digisonic® SP EVO cochlear implant and the associated surgical technique.
- Before implantation, patients should be informed of the bene ts of a cochlear implant, but also of its potential
risks (see §7).
Intraoperative management
- Determining the location of the incision and the position of the receiver: Before making the incision for
the skin ap, it is recommended to determine the optimal site of the implanted system. In doing so, the location
of the incision should account for the fact that the implant should be placed far enough from the auricle to allow
space for the behind the ear processor without interfering with the external antenna. In addition, the incision
line should be far enough away from the implant to prevent the risk of extrusion or postoperative infection.
It is therefore recommended to use a sterile skin marker to draw the retroauricular incision line about 1cm
away from the retroauricular crease, and to draw the receiver’s position about 2cm away from the auricle
of the ear. These locations can be determined by using the implant template and the processor template
(suppliedseparately upon request) placed over the ear.
After making the incision, use the implant template for preparing the site so that the receiver is properly
positioned. The surface of the bone should be checked to make sure it is at enough to hold the receiver
inplace with screws.
- Handling the implant: Remove the implant from the sales packaging only after completing the standard
surgical procedures up until the cochleostomy. Remove the outer packaging and make sure the implant is not
damaged. Carefully cut the suture threads holding the implant in place and remove it from the sterile implant
holder. Avoid touching and/or bending the electrode array. Do not use sharp surgical instruments that could
damage the electrode-array.
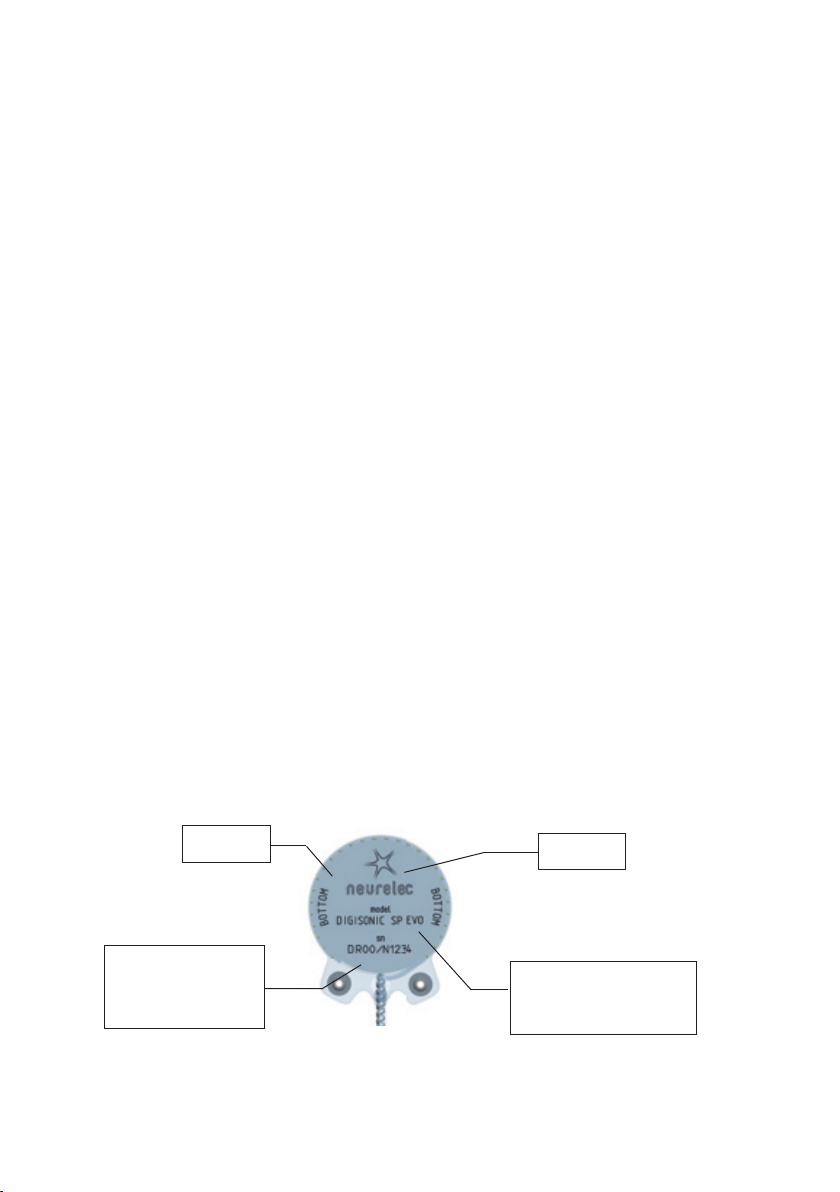
- Orientation of the implant: The engraved side of the Digisonic® SP EVO implant (NEURELEC, BOTTOM)
should be faced toward the skull and should not be visible. This metal titanium plate contains important
information that identi es the implant as follows:
Information facing
the bone Name of the
manufacturer
Serial number (SN):
DR: Digisonic Receiver
00: year of manufacture
N: SP EVO version
1234: incremental
number
Type of implant (model):
TheDigisonic® SP EVO implant
is identi ed by the inscription
DIGISONIC®SP EVO

7
Gently position the rst screw into one of the xation system’s titanium inserts. It is recommended to hold
thescrewdriver vertical to the implant axis for xation. Tighten the screw all the way, then gradually withdraw
the screwdriver making a slight circular motion. Check that it is secure, then repeat the same procedure for the
second screw.
Note: Neither the surgeon nor any person not authorized by Neurelec may make changes to the implant
(suchasto the xation system).
- Inserting the electrode-array: Insert the electrode-array so that it will follow the cochlear spiral when inserted.
Guide the tip of the electrode-array towards the base of the scala tympani using the insertion claw or micro-
jeweler forceps. Then gradually advance the electrode-array using minimal force. Finish insertion by using
the silicone extracochlear push rings as reference. Once insertion is complete, the rings should block the
cochleostomy. The electrode array may be secured to prevent the risk of migration. The xation method and
xation points will depend on the surgical access and the surgeon’s preferences.
- Positioning the reference electrode: Place the head of the extracochlear reference electrode against
thebone under the temporal muscle.
- Conrming the implant is functioning: Measuring impedance, before or after the incision is closed,
canensure that the implanted device is functioning properly.
11. EXPLANTATION
If malfunction of the Digisonic® SP EVO implant is suspected, the system must be examined with the help of
Neurelec clinical support. If malfunction of the implant is conrmed and the medical team decides to explant,
it is important to contact Neurelec, who will inform you of the explantation procedure to follow. It is especially
important to request an explantation kit from Neurelec so that the explanted system may be sent back, thereby
making it possible to examine the device.
tabs is required for system xation. The implanted receiver must be xed with the
supplied screws to prevent any possible displacement, which could create stress
and possibly damage the electrode wires. It is always recommended to secure
it in place with the two self-tapping screws provided in the packaging, and pre-
positioned in the implant holder. Follow the steps below to remove the screws from
the holder:
• Insert the screwdriver (provided with the initial surgical kit) into the screw
using rm axial pressure.
• Unscrew the screw while slowly withdrawing it from the holder.
• The screw is now attached to the screwdriver and can be used.
- Fixation of the implant: No milling of the bone is needed for the implant bed. Simply slide the receiver under
the temporal muscle into the prepared site using the silicone template. Make sure the implant is positioned
properly and does not move when nger pressure is applied. Only access to the implant’s mounting
8
12. TECHNICAL SPECIFICATIONS OF THE DIGISONIC® SP EVO IMPLANT
Primary function Cochlear implant
Stimulation mode Balanced biphasic stimulation
Rate of stimulation 24,000 maximum pps (pps: pulse per second)
Other available functions
- Impedance measurement
- Measurement of the implant’s power
- Integrity test*
- EABR (Evoked Auditory Brainstem Response)*
- Stapedius reex
Psychoacoustic tests (gap test, etc.)*
* with associated equipment
Weight 10.5 g
Dimensions Diameter 30.2 mm – Thickness: ranging from 4.9
(edge) to 5.75 mm (center)
Volume 4 cm3
Material in direct contact with human tissue
- LSR 40 shore A silicone
- HCR 35 shore A & HCR 50 shore A
- Adhesive silicone
- Platinum iridium 10%
- Titanium grade 2
- Titanium grade 5
13. PERFORMANCE CHARACTERISTICS
Characteristics of the output signal (on resistance
of 1 kΩ) Max 2V -255µs U: 0 to 4V
I: 10 µA to 2 mA
Δt: 10 µs to 255 µs
Impedance measurement Yes: Normal values: 500Ω – 5kΩ
MRI safety level Compatible with 1.5 Tesla. Refer to the
recommendations
Methods recommended for determining the proper
functioning of the system Yes. Impedance measurement and integrity test
(with collection equipment)
14. SPECIFICATIONS AND CHARACTERISTICS OF THE ELECTRODE-ARRAY
Monopolar electrical congurations Common ground
Number of independent active electrodes 20
Reduced cochleostomy size Diameter of 0.8mm
General shape Straight with shape memory
Straight : distance between electrodes and silicon,
inferior to 0.1mm
Shape at apex Rounded shape
Shape at the base 2 1.5mm-diameter push rings
Material components - Connecting wire: Platinum iridium 10%
- Stimulation electrodes: Platinum iridium 10%
Insulation PE (polyester)
Dimensions
- Length; 25mm
- Diameter at the base and at the apex: 0.5mm
and0.4mm
- Minimum and maximum surface area of the
stimulation electrodes: 0.46mm² (0.59mm² theorical
cylinder) et 0.60mm² (0.74mm² theorical cylinder)
- Distance between electrodes: 0.7mm
- Maximum distance between proximal and distal
electrodes: 22.3mm
Flexibility - The insertion force is less than 32% above insertion
of 200°, compared to the Digisonic®SP implant.

9
- In case of doubt about the specied performance, please contact Neurelec customer service for your safety.
- Should you have any comments or if the information provided is incomplete, please contact your manufacturer
or your local distributor.
Digisonic® SP EVO is a registered trademark of Neurelec-France

10
SOMMAIRE
1. DESCRIPTION DU DISPOSITIF 11
Désignation du modèle 11
Identication commerciale 11
Descriptif du dispositif 11
2. CONTENU DE L’EMBALLAGE 11
3. LISTE DES ACCESSOIRES COMPATIBLES 11
4. SYMBOLES ET SIGNIFICATIONS 11
5. INDICATIONS 11
6. CONTRE-INDICATIONS MEDICALES 12
7. EFFETS SECONDAIRES INDESIRABLES 12
8. PRECAUTIONS D’UTILISATION 12
9. MISE EN GARDE, INTERACTION AVEC LES THERAPIES ET INVESTIGATIONS
CLINIQUES 12
Mise en garde 12
Champ électrique de haute énergie 12
Electrothérapie 12
Electrochirurgie 12
Electrochocs, débrilation 12
Diathermie médicale 12
Diagnostic et traitement aux ultrasons 12
Rayonnements ionisants thérapeutiques (radiothérapie) 12
Rayonnements électromanétiques non ionisants 12
IRM (Imagerie par Résonnance Magnétique 12
10. MODE D’EMPLOI 14
Electro-chirurgie 14
Pré-opératoires 14
Per-opératoires 14
Repérage de l’incision et de la position du récepteur 14
Manipulation de l’implant 14
Orientation de l’implant 14
Fixation de l’implant 15
Insertion du porte-électrodes 15
Positionnement de l’électrode de référence 15
Vérication du fonctionnement de l’implant 15
11. EXPLANTATION 15
12. SPECIFICATIONS TECHNIQUES DE L’IMPLANT DIGISONIC®SP EVO 16
13. CARACTERISTIQUES DE PERFORMANCES 16
14. SPECIFICATIONS ET CARACTERISTIQUES DU RESEAU D’ELECTRODES 16

11
1. DESCRIPTION DU DISPOSITIF
• Désignation du modèle
Implant cochléaire Digisonic®SP EVO
• Identication commerciale
I-SP-SD-EVO
•Descriptif du dispositif
Le Digisonic®SP EVO est un implant cochléaire multicanaux destiné à la réhabilitation des surdités de per-
ception bilatérales sévères (2ème degré) à profondes. Cet implant cochléaire, de type transcutané, fonctionne
avec un processeur externe de type contour d’oreille (DIGI SP/ SAPHYR® SP/ZEBRA) ou de type micro-contour
d’oreille avec batterie déportée (DIGI SP’K). Une antenne externe transmet par couplage électromagnétique
le signal acoustique traité par le processeur, à l’implant Digisonic®SP EVO implanté sous la peau derrière le
pavillon de l’oreille.
Le Digisonic® SP EVO comprend un porte-électrodes de 20 électrodes qui est inséré dans la cochlée (oreille
interne). Chaque électrode stimule diérents contingents de bres nerveuses auditives et est associée à
une bande de fréquences du signal sonore traité par le processeur externe. L’implant et l’antenne externe
contiennent un aimant, l’antenne externe est ainsi maintenue en regard de l’implant par attraction magnétique.
Le Digisonic® SP EVO ne contient pas d’alimentation électrique propre, il reçoit l’énergie nécessaire à son fonc-
tionnement par couplage électromagnétique. Ainsi lorsque l’antenne externe n’est pas positionnée en regard du
Digisonic®SP EVO, l’implant est passif.
2. CONTENU DE L’EMBALLAGE
1 implant Digisonic® SP EVO (I-SP-SD-EVO), 1 gabarit d’implant en silicone, 1 système de xation, 1 carte de
porteur, les documents d’accompagnement.
3. LISTE DES ACCESSOIRES COMPATIBLES
L’implant est fourni avec les accessoires suivants :
• 1 gabarit d’implant en silicone utilisé pendant la chirurgie pour vérier le bon positionnement de l’implant
sous la peau.
• 2 vis auto-taraudeuses utilisées pour la xation de l’implant en position ; elles ne nécessitent pas de perçage
préalable.
4. SYMBOLES ET SIGNIFICATIONS
Référence catalogue Attention. Il est nécessaire de consulter
les documents d’accompagnement
Méthode de stérilisation : oxyde d’éthylène
Produit livré stérile Limitation d’humidité comprise entre
15% et 75%.
Dispositif à usage unique, ne pas réutiliser Date de fabrication
Condition de STOCKAGE : stocker dans
un endroit sec et frais Température de
stockage de -20° C à +50° C. Code de lot
Fragile ; manipuler avec soin Date limite d’utilisation
Ne pas utiliser si l’emballage est endom-
magé Numéro de série
Ne pas re-stériliser Fabricant
Déchets d’équipement d’appareils élec-
triques et électroniques (DEEE) Instructions de fonctionnement
5. INDICATIONS
L’implant cochléaire multicanaux Digisonic®SP EVO est destiné à la réhabilitation des surdités sévères de 2eme
degré à totales bilatérales avec une intelligibilité inférieure à 50% à 60dBHL en champ libre avec prothèses
auditives (avis médical indispensable).

12
6. CONTRE-INDICATIONS MEDICALES
L’implant cochléaire Digisonic® SP EVO n’est pas indiqué pour les personnes sourant de surdité de perception
accompagnée d’importantes lésions de la cochlée (malformation cochléaire majeure, fracture du rocher, ossi-
cation importante dans la cochlée), du nerf auditif (neuropathie axonale, tumeur à proximité ou sur le nerf auditif
comme les neurinomes, destruction complète des deux nerfs auditifs), d’une atteinte sévère des voies auditives,
de maladies de l’oreille moyenne aigües ou chroniques (incluant la perforation de la membrane tympanique),
d’une condition psychologique fragile ou d’une allergie au contact des matériaux de l’implant (silicone, platine
iridium, titane). D’autres types d’implants pourront être proposés.
7. EFFETS SECONDAIRES INDÉSIRABLES
Pour les patients répondant aux indications, l’implantation présente tout d’abord les risques classiques liés à
l’opération chirurgicale (suites de l’anesthésie générale, infections…) pour lesquels le produit en lui-même n’est
pas responsable. Il existe cependant un risque de rejet de l’implant ou d’une partie de l’implant par l’organisme
du patient : ce risque a été diminué en proposant des matériaux biocompatibles lors de la conception.
Les risques de complications associés à la technique opératoire de l’implant cochléaire (paralysie faciale transi-
toire ou dénitive, risque méningé, modication du goût, vertiges, acouphènes, etc.) sont rares mais doivent ce-
pendant être considérés avec attention. Il est donc important d’informer tout candidat à l’implantation cochléaire
sur ces risques potentiels. Une information particulière doit être formulée au patient concernant les symptômes
et premiers signes de méningite. Selon les recommandations en vigueur, la vaccination antipneumococcique
est par ailleurs vivement recommandée.
Une fois l’implant posé, il demeure des risques pouvant entraîner une explantation, avec pour conséquence un
nouvel acte chirurgical avec anesthésie générale. L’explantation peut avoir lieu dans plusieurs cas :
- Complication médicale
- Dysfonctionnement de l’implant
- Déplacement du dispositif après un choc traumatique
- Extrusion de l’implant
Ces cas ont été évalués au cours de la conception du produit. Aussi, des choix technologiques ont orienté sa
conception dans le but de les limiter.
Enn, les eets à long terme résultant des traumatismes liés à l’insertion des électrodes et à la stimulation
électrique chronique sont inconnus à ce jour. Ces eets pourraient être une ossication cochléaire ou une dégé-
nérescence des bres nerveuses, et pourraient avoir pour conséquence le remplacement de l’implant, ou une
dégradation de la réponse à la stimulation.
8. PRÉCAUTIONS D’UTILISATION
Informations à donner au Patient :
- L’informer des bénéces de l’implant cochléaire, et de ses eets secondaires indésirables éventuels (cf §7).
- La carte de porteur, qui lui est remise, doit être dûment complétée.
- Lui indiquer qu’il est impératif de présenter la carte-porteur pour tout examen ou traitement médical.
- Lui recommander de lire attentivement la notice d’utilisation remise avec son processeur externe et notamment
le paragraphe concernant les précautions d’emploi.
- En cas de défaillance ou de modication du fonctionnement du système d’implant cochléaire, lui indiquer de
contacter son centre d’implantation.
- Les sports de contact (ex : rugby, boxe...) devront être vivement déconseillés, un choc violent dans la région
de l’implant pourrait l’endommager.

13
- Plongée sous-marine : La pratique occasionnelle de la plongée autonome n’est pas conseillée en dessous
de 20m de profondeur. En eet, une surpression pourrait endommager l’implant. D’autre part, il est fortement
déconseillé de pratiquer une activité professionnelle de plongée sous-marine ; l’implant n’étant pas garanti pour
des sollicitations répétées de surpression.
- Accès aux zones protégées : Prendre l’avis du médecin avant de pénétrer dans des zones d’accès protégées
(salle d’examen IRM, portique de détection, cabine de scanner 3D…).
9. MISES EN GARDE, INTERACTION AVEC LES THÉRAPIES ET INVESTIGATIONS CLINIQUES
- Mise en garde : Les parties implantables du dispositif ne doivent pas être réutilisées si celles-ci ont été préa-
lablement implantées chez un autre patient.
- Champ électrique de haute énergie :
- Electrothérapie : L’électrothérapie peut envoyer des courants plus ou moins forts. Le recours aux tech-
niques d’électrothérapie à courants électriques de haut voltage est interdit pour risque de dommages sur le
système d’implant. Cependant, l’électrothérapie à faible voltage peut être envisagée à la seule condition que
les électrodes ne soient pas posées sur les zones de la tête et du cou.
- Electrochirurgie : Eviter l’utilisation d’instruments électro-chirurgicaux monopolaires. Ces instruments
peuvent produire des champs radio-fréquence avec des tensions électriques susceptibles de créer un cou-
plage entre l’extrémité de l’instrument et le porte-électrodes. Des courants induits pourraient endommager
les tissus cochléaires ou générer des dégâts permanents à l’implant. Ainsi, au bloc opératoire, dès qu’un
implant cochléaire est sorti de son emballage, tout bistouri monopolaire se doit d’être éteint pour éviter tout
dommage à l’implant. Cependant, l’emploi de bistouris électriques bipolaires est autorisé tant qu’il n’est
pas au voisinage ou en contact direct avec l’implant cochléaire.
- Electrochocs, débrillation : L’envoi de chocs électriques de plusieurs milliers de volts parcourant
le corps est déconseillé sur un patient porteur d’implant cochléaire. Les électrochocs peuvent causer des
dégâts tissulaires dans la cochlée ou générer des dommages permanents à l’implant.
Dans le cas où une situation est vitale, seule l’équipe médicale est en mesure de prendre une décision. Dans
le cas où la situation n’est pas vitale pour le patient, merci de prendre contact avec Neurelec
- Diathermie médicale : Il est interdit d’utiliser la diathermie par rayons électromagnétiques sur un patient por-
teur d’éléments implantés contenant du métal. Celle-ci peut causer des dommages irréversibles sur les tissus
(brûlure de la cochlée) et sur l’implant. Cependant, la diathermie par ultrasons peut être envisagée sur les
zones corporelles ne touchant pas celles de la tête et du cou.
- Diagnostic et traitement aux ultrasons : L’implant ne doit pas être exposé à des niveaux thérapeutiques
d’énergie ultrasonique. En eet, le dispositif peut par inadvertance concentrer le champ ultrasonique et subir
des dommages.
- Rayonnements ionisants thérapeutiques (radiothérapie) : Lors des séances de radiothérapie, il est forte-
ment déconseillé d’irradier directement la zone de l’implant. Une exposition massive et directe de l’implant aux
rayons pourrait entraîner une perte partielle, voire totale, des fonctionnalités de l’implant. Les dommages ne sont
pas forcément manifestes.
- Rayonnements électromagnétiques non ionisants :
- IRM (Imagerie par Résonance Magnétique) : L’implant Digisonic®SP EVO contient un aimant permanent.
Un examen IRM ou l’application d’un champ magnétique intense au voisinage de l’implant pourrait occasion-
ner des dommages à l’implant et/ou au patient. Il est cependant possible d’eectuer un examen IRM à 1,5
Tesla en respectant les recommandations. Dans ce cas, le radiologue doit remplir un formulaire d’examen
disponible sur le site www.neurelec.com.
Se référer au manuel utilisateur du processeur pour obtenir des informations complémentaires.
14
Indication
face côté os Nom
du fabricant
Numéro de série (sn) :
DR : Digisonic Receiver
00 : année de fabrication
N : version SP EVO
1234 : n° incrémental
10. MODE D’EMPLOI
Attention !
Electrochirurgie : Dès la mise en place de l’implant, la suite du geste chirurgical ne doit plus s’e ectuer à
l’aide d’instruments électro-chirurgicaux monopolaires. Ces instruments peuvent produire des champs radio-
fréquence avec des tensions électriques susceptibles d’endommager l’implant. L’emploi du bistouri élec-
trique bipolaire est autorisé tant qu’il n’est pas au voisinage ou en contact direct avec l’implant cochléaire.
Pré-opératoires
- Avant d’e ectuer sa première implantation de Digisonic® SP EVO, l’opérateur doit s’informer des spéci cations
techniques particulières de l’implant cochléaire Digisonic® SP EVO et de la technique chirurgicale associée.
- Avant l’implantation, les patients doivent être informés des béné ces de l’implant cochléaire et de ses risques
éventuels secondaires (voir §7).
Per-opératoires
- Repérage de l’incision et de la position du récepteur : Avant de procéder à l’incision du lambeau cutané, il
est conseillé de repérer la position du système implanté. Ainsi, la détermination de l’incision doit considérer le
fait que l’implant ne doit pas être positionné sous le pavillon mais à une distance su samment importante pour
permettre au patient de porter le processeur contour d’oreille sans con it avec la position de l’antenne externe.
D’autre part, la ligne d’incision doit être située à une distance su sante de l’implant a n d’éviter tout risque d’ex-
trusion ou d’infection post-opératoire. Il est donc conseillé de marquer avec un crayon dermographique stérile
la ligne d’incision rétro-auriculaire décalée d’environ un centimètre du sillon rétro-auriclaire, ainsi que la position
du récepteur à environ 2cm du pavillon de l’oreille, dont la localisation est déterminée grâce à l’emploi du gabarit
d’implant et du gabarit de processeur (fourni séparément sur demande) à placer en position sur l’oreille.
Lorsque l’incision est réalisée, utiliser le gabarit d’implant pour préparer l’emplacement nécessaire au bon posi-
tionnement du récepteur. Il est recommandé de véri er que la surface osseuse est su samment plane pour
faciliter la xation ultérieure du récepteur à l’aide des vis.
- Manipulation de l’implant : Retirer l’implant de la boite commerciale uniquement après avoir réalisé les étapes
chirurgicales classiques jusqu’à l’abord de la cochléostomie. Ouvrir alors l’emballage externe en s’assurant que
l’implant n’est pas endommagé. Retirer ensuite délicatement l’implant de son support stérile après avoir coupé
avec précaution les ls de suture de maintien. Eviter de toucher et/ou de plier le porte-électrodes, et ne pas
utiliser d’instruments chirurgicaux coupants qui pourraient endommager le porte-électrodes.
- Orientation de l’implant : La face gravée de l’implant Digisonic® SP EVO (NEURELEC, BOTTOM) ne doit pas
être visible en con guration d’utilisation et donc orientée du côté du crâne. Cette plaque métallique en titane
comporte certaines informations importantes permettant l’identi cation de l’implant qui sont détaillées ci-après :
Type d’implant (model) :
L’implant Digisonic® SP EVO
est identi é par l’inscription
DIGISONIC®SP EVO

15
Venir délicatement positionner la première vis dans l’un des inserts en titane du système de xation. Il est recom-
mandé de maintenir le tournevis en position verticale en rapport avec l’axe de l’implant pour faciliter la xation.
Visser jusqu’à ressentir un blocage, puis dégager progressivement le tournevis en appliquant un petit mouve-
ment circulaire sur celui-ci. Vérier la bonne tenue puis recommencer la même procédure avec la deuxième vis.
Attention : Aucune modication ne peut être apportée sur l’implant (ex : système de xation) par le chirurgien ou
toute autre personne non habilitée par Neurelec.
- Insertion du porte-électrodes : Orienter le porte-électrodes de façon à procéder à une insertion qui suive
la spirale cochléaire. Guider l’extrémité du porte-électrodes vers le fond de la rampe tympanique à l’aide de la
fourchette d’insertion ou d’une ne pince puis insérer progressivement le porte-électrodes en forçant le moins
possible. Finaliser l’insertion en prenant appui sur les anneaux de poussée extra-cochléaires en silicone. A la
n de l’insertion, les anneaux doivent obstruer la cochléostomie. Le porte-électrodes peut être xé an d’éviter
tout risque de migration. La méthode utilisée ainsi que les points de xation dépendent de l’accès chirurgical et
des préférences du chirurgien.
- Positionnement de l’électrode de référence : Placer l’électrode de référence boule extra-cochléaire contre
l’os sous le muscle temporal.
- Vérication du fonctionnement de l’implant : La réalisation de mesures d’impédances, avant ou après la
fermeture de l’incision, permet de s’assurer du bon fonctionnement du dispositif implanté.
11. EXPLANTATION
En cas de suspicion de dysfonctionnement de l’implant Digisonic®SP EVO, il est nécessaire de mener une
expertise du système avec la collaboration du référent clinique Neurelec. Dans le cas où le dysfonctionnement
de l’implant serait conrmé et que la décision de l’équipe médicale amène au choix d’une désimplantation, il
est important de contacter Neurelec qui vous informera de la procédure d’explantation à suivre. Notamment, il
est nécessaire de demander auprès de Neurelec le kit d’explantation qui permettra de réacheminer le système
désimplanté et ainsi mener l’expertise du dispositif
nécessaire pour permettre la xation du système. Le récepteur implanté doit être
impérativement stabilisé an d’éviter des déplacements éventuels pouvant créer
des tensions et engendrer un dommage potentiel au niveau des ls d’électrodes. Il
est donc recommandé de le maintenir en place par les deux vis auto-taraudantes
fournies dans le packaging, pré-positionnées sur le support de l’implant. Pour reti-
rer les vis de leur support respectez-la procédure suivante:
• Introduire le tournevis dans la vis en exerçant une ferme pression axiale.
• Dévisser la vis en retirant lentement la vis du support.
• La vis est maintenant xée sur le tournevis et peut être utilisée.
- Fixation de l’implant : Aucun fraisage osseux pour le lit d’implant n’étant nécessaire, il sut de faire glisser le
récepteur sous le muscle temporal, dans l’emplacement préparé à l’aide du gabarit en silicone. S’assurer que
l'implant est bien placé et ne peut basculer sous la pression des doigts. Seul l’accès aux ailettes de l’implant est

16
12. SPÉCIFICATIONS TECHNIQUES DE L’IMPLANT DIGISONIC® SP EVO
Fonction principale Implant cochléaire
Mode de stimulation Stimulation biphasique équilibrée
Vitesse de stimulation 24000 pps maximum (pps : pulsation par seconde)
Autres fonctions disponibles
- Mesure d’impédance
- Mesure d’alimentation de l’implant
- Test d’intégrité*
- PEA (Potentiels Evoqués Auditifs)*
- Réexe stapédien
Tests psycho-acoustiques (gap test, etc.)*
* avec équipements associés
Masse 10,5 g
Dimensions Diamètre 30,2 mm – Epaisseur : de 4,9 mm (bord) à
5,75 mm (centre)
Volume 4 cm3
Matériaux en contact direct avec les tissus humains
- Silicone LSR 40 shore A
- Silicone HCR 35 shore A et HCR 50 shore A
- Silicone adhésif
- Platine iridium 10%
- Titane grade 2
- Titane grade 5
13. CARACTÉRISTIQUES DE PERFORMANCES
Caractéristiques du signal de sortie (sur résistance
de 1 kΩ) Max 2V -255 µs U : 0 à 4 V
I : 10 µA à 2 mA
Δt : 10 µs à 255 µs
Mesure d’impédance Oui : Valeurs usuelles : 500Ω – 5kΩ
Niveau de sécurité IRM Compatible 1,5 Tesla.
Se référer aux recommandations
Méthodes recommandées pour déterminer le bon
fonctionnement du système Oui. Mesure d’impédance, et test d’intégrité (avec
équipement de recueil)
14. SPÉCIFICATIONS ET CARACTÉRISTIQUES DU RÉSEAU D’ÉLECTRODES
Congurations électriques monopolaires Common ground
Nombre d’électrodes actives indépendantes 20
Cochléostomie réduite Diamètre 0,8 mm
Forme générale Droit avec mémoire de forme
Lisse : Décalage entre électrodes et silicone
inférieur à 0.1mm
Forme à l’apex Forme arrondie
Forme à la base 2 anneaux de poussée de diamètre 1,5 mm
Matériaux constituant - Fil de liaison : Platine iridium 10%
- Electrodes de stimulation : Platine iridium 10%
Isolant PE (polyester)
Dimensions
- Longueur : 25mm
- Diamètre à la base et à l’apex : 0,5 mm et 0,4 mm
- Surface min. et max. des électrodes de stimulation :
0,46 mm² (0.59mm² cylindre théorique) et 0,60mm²
(0,74mm² cylindre théorique).
- Distance entre chaque électrode : 0,7 mm
- Distance maxi entre électrode proximale et distale :
22,3 mm
Flexibilité - Eort d’insertion inférieur de 32% après une insertion
de 200° par rapport à l’implant Digisonic®SP

17
- En cas de doute sur les performances indiquées, pour votre sécurité, veuillez contacter le Service Client de
Neurelec.
- Pour toute remarque ou si vous constatez que les informations fournies restent incomplètes, merci de contacter
votre fabriquant ou votre distributeur local.
Digisonic® SP EVO est une marque déposée de Neurelec-France

18
INHALTSVERZEICHNIS
1. BESCHREIBUNG DES GERÄTS ..............................................................................................19
Name des Modells.............................................................................................................19
Handelsbezeichnung ........................................................................................................19
Gerätebeschreibung .........................................................................................................19
2. INHALT DES PAKETS ...............................................................................................................19
3. LISTE KOMPATIBLER ZUBEHÖRTEILE..................................................................................19
4. SYMBOLE UND DEREN BEDEUTUNG....................................................................................19
5. INDIKATIONEN ..........................................................................................................................19
6. MEDIZINISCHE GEGENANZEIGEN .........................................................................................20
7. UNERWÜNSCHTE NEBENEFFEKTE ......................................................................................20
8. BEI DER BENUTZUNG ZU BEACHTENDE WARNHINWEISE ................................................20
9. ACHTUNG: WECHSELWIRKUNG MIT BEHANDLUNGEN
UND KLINISCHEN UNTERSUCHUNGEN ....................................................................................21
Achtung .............................................................................................................................21
Elektrisches Hochspannungsfeld......................................................................................21
Elektrotherapie ............................................................................................................21
Elektrochirurgie ...........................................................................................................21
Elektroschock-Therapie und Debrillation ..................................................................21
Medizinische Diathermie ...................................................................................................21
Diagnostische Untersuchungen oder Behandlungen mit Ultraschall ...............................21
Ionisierende Strahlentherapie............................................................................................21
Nichtionisierende elektromagnetische Strahlung..............................................................21
MRT (Magnetresonanztomographie) ..........................................................................21
10. GEBRAUCHSANWEISUNG ....................................................................................................22
Elektrochirurgie..................................................................................................................22
Präoperatives Management ..............................................................................................22
Intraoperatives Management.............................................................................................22
Festlegung der Einschnittstelle und der Postion des Empfängers .............................22
Handhabung des Implantats ......................................................................................22
Ausrichten des Implantats ..........................................................................................22
Befestigung des Implantats .......................................................................................23
Einführen der Elektrodenanordnung ...........................................................................23
Positionierung der Referenzelektrode.........................................................................23
Überprüfen Sie die korrekte Funktion des Implantats.................................................23
11. EXPLANTATION ......................................................................................................................24
12.TECHNISCHE DATEN DES DIGISONIC® SP EVO IMPLANTATS .........................................24
13. LEISTUNGSDATEN .................................................................................................................24
14.TECHNISCHE DATEN UND MERKMALE DER ELEKTRODENANORDNUNG.....................24

19
1. BESCHREIBUNG DES GERÄTS
• Name des Modells
Digisonic®SP EVO Cochlea-Implantat
• Handelsbezeichnung
I-SP-SD-EVO
• Gerätebeschreibung
Das Digisonic®SP EVO ist ein Multi-Kanal-Cochlea-Implantat, das konzipiert wurde, um die Rehabilitation von
Patienten zu verbessern, die unter einem schweren (2. Grades) oder an Taubheit grenzenden, bilateralen
Gehörverlust leiden. Dieses Cochlea-Implantat arbeitet in Verbindung mit einem externen HdO-Prozessor (DIGI
SP/ SAPHYR® SP/ZEBRA/DIGI SP’K). Die elektromagnetische Induktion zwischen einer externen und einer
internen Antenne übermittelt das akustische Signal, das vom Prozessor verarbeitet wird, an den Digisonic®SP
EVO Empfänger, der direkt hinter der Ohrmuschel unter der Haut implantiert wurde.
Das Digisonic®SP EVO beinhaltet eine Elektrodenanordnung mit 20 Elektroden. Diese Elektrodenanordnung
wird direkt in die implantierte Cochlea eingeführt. Jede einzelne Elektrode stimuliert unterschiedliche Gruppen
von Hörnervfasern und jede Gruppe entspricht einem anderen Frequenzband. Das Implantat und die externe
Antenne enthalten Magnete, die beide Geräte für eine optimale Leistung in einer korrekten relativen Position
halten. Das Digisonic® SP EVO enthält keine Stromquelle und wird nur mit Strom versorgt, wenn die externe
Antenne installiert ist. Wenn die externe Antenne nicht installiert ist, wird dasDigisonic®SP EVO nicht mit Strom
versorgt und arbeitet nicht.
2. INHALT DES PAKETS
1 Digisonic® SP EVO (I-SP-SD-EVO) Implantat, 1 Implantatmodell aus Silikon, 1 Befestigungssystem,
1 Identikationskarte mit beigefügter Dokumentation.
3. LISTE KOMPATIBLER ZUBEHÖRTEILE
Das Implantat wird mit folgenden Zubehörteilen geliefert:
• 1 Silikonimplantat-Modell, das während des Eingris benutzt wird, um die korrekte Position des Implantats
unter der Haut zu überprüfen.
• 2 selbstschneidende Schrauben, um das Implantat in Position zu halten. Ein Vorbohrenist nicht erforderlich.
4. SYMBOLE UND DEREN BEDEUTUNG
Katalogreferenz Wichtig. Bitte lesen Sie die beigefügte
Dokumentation.
Sterilisationsmethode: Ethylenoxid
Produkt sterilisieren Feuchtigkeitspegel zwischen 15 % und
75 % halten
Einmal-Gerät, nicht erneut verwenden. Herstellungsdatum:
LAGERUNGSBEDINGUNGEN: kühl und
trocken lagern. Lagertemperatur zwischen
-20 °C und +50 °C Chargen-Code
Zerbrechlich; vorsichtig handhaben Ablaufdatum
Nicht verwenden, wenn die Verpackung
beschädigt ist Seriennummer
Nicht erneut sterilisieren Hersteller
Elektrischer und elektronischer Abfall
(WEEE) Gebrauchsanweisung
5. INDIKATIONEN
Das Digisonic® SP EVO Multikanal-Cochlea-Implantat ist für die Versorgung von Patienten konzipiert, die unter
einem hochgradigen bis an Taubheit grenzenden Hörverlust (2. Grades) leiden und eine Sprachverständlichkeit
von weniger als 50% bei 60 dB HL in einem Sprachtest mit einem Hörgerät erreichen (dazu ist eine fachliche
Empfehlung erforderlich).

20
6. MEDIZINISCHE GEGENANZEIGEN
Das Digisonic®SP EVO Cochlea-Implantat ist nicht indiziert bei Patienten mit Hörverlust und gleichzeitigen starken
Läsionen in der Hörschnecke (erhebliche Missbildung, Bruch der Felsenbeinpyramide, starke Verknöcherung
der Cochlea), Verletzungen des Hörnervs (axonale Neuropathie, Tumor am Hörnerv oder in der Nähe, wie z.
B. ein Akustikusneurinom, eine vollständige Zerstörung beider Hörnerven), die unter einer schweren Anomalie
der Hörnervenbahnen, unter akuten oder chronischen Mittelohrerkrankungen (einschließlich einer Perforation
des Trommelfells) leiden und die psychologisch instabil sind oder eine Kontaktallergie gegenüber Implantat-
Werkstoen (Silikon, Platin-Iridium, Titan) haben. Hier können andere Implantat-Typen empfohlen werden.
7. UNERWÜNSCHTE NEBENEFFEKTE
Patienten, die den Indikationen für eine Implantation entsprechen, müssen die mit dem chirurgischen Eingri
verbundenen produktabhängigen Risiken akzeptieren (Nachwirkungen einer Allgemeinnarkose, Infektionen,
etc.). Allerdings besteht auch einRisiko, dass der Körper des Patienten das Implantat oder Teile des Implantats
abstößt. Dieses Risiko ist durch die Verwendung von biokompatiblen Materialien minimiert worden.
Komplikationen in Verbindung mit dem chirurgischen Eingri der Cochlea-Implantation (partielle oder
permanente Gesichtslähmung, Gefahr einer Meningitis, Geschmacksveränderungen, Schwindel, Tinnitus, etc.)
sind selten, sollten aber sorgfältig berücksichtigt werden. Es ist wichtig, jeden voraussichtlichen Implantat-
Anwärter über diese potenziellen Risiken zu informieren. Der Patient sollte spezische Informationen bezüglich
der Symptome und der ersten Zeichen einer Meningitis erhalten. Gemäß den aktuellen Empfehlungen wird eine
Pneumokokken-Impfung nachdrücklich empfohlen.
Wenn das Implantat eingesetzt ist, verbleiben bestimmte Risiken, die zu einer Explantation führen können.
Die Explantation macht einen zusätzlichen Eingri unter Allgemeinnarkose erforderlich. Eine Explantation kann
in folgenden Fällen vorkommen:
- Medizinische Komplikationen
- Fehlfunktion des Implantats
- Eine Verschiebung des Geräts auf Grund eines Traumas
- Ausstoßung des Implantats
Diese potenziellen Probleme wurden während der Produktkonzipierung ausgewertet und die Materialien sowie
das Design des Implantats wurden so gewählt, um diese Risiken zu minimieren.
Die Langzeitauswirkungen des Traumas durch das Einführen von Elektroden und der ständigen elektrischen
Stimulation sind heute noch unbekannt. Diese Auswirkungen können eine Verknöcherung der Cochlea oder eine
Degeneration der Nervenfasern beinhalten und einen Austausch des Implantats erforderlich machen oder zu
einer verminderten Antwort auf die Stimulation führen.
8. BEI DER BENUTZUNG ZU BEACHTENDE WARNHINWEISE
Informationen, die dem Patienten bereitzustellen sind:
- Der Patient sollte über die Vorteile eines Cochlea-Implantats, aber auch über die möglichen unerwünschten
Nebeneekte informiert werden (siehe §7).
- Die mitgelieferte Identikationskarte muss ausgefüllt werden.
- Der Patient muss informiert werden, dass er die Identikationskarte vor jeder medizinischen Untersuchung oder
Behandlung vorzeigen muss.
- Raten Sie dem Patienten, die seinem externen Prozessor beigefügte Gebrauchsanweisung sorgfältig
durchzulesen, insbesondere den Abschnitt mit den Warnhinweisen, die bei der Benutzung zu beachten sind.
- Sollte das Cochlea-Implantat-System ausfallen oder eine Fehlfunktion aufweisen, so ist der Patient/die Patientin
gehalten, sich an sein/ihr Implantationszentrum zu wenden.
- Von Kampfsportarten (Rugby, Boxen, etc.) wird nachdrücklich abgeraten, da starke Stöße auf diesen Bereich
das Implantat beschädigen können.
Table of contents
Languages: