Promedon Splentis User manual

M-90-15-2685(03) / 8-Nov-17
Instructions for use
ENGLISH
Instructions D’Utilisation
FRANÇAIS
Gebrauchsanweisung
DEUTSCH
Instrucción de uso
ESPAÑOL
Instrução de uso
PORTUGUES
Istruzioni Per l’uso
ITALIANO
TÜRKÇE
Brugsanvisning
DANSK
ROMAN
SlOvAK
CZECH


INSTRUCTIONS FOR USE
DESCRIPTION
Splentis is a kit comprising:
• 3 TAS anchors (Tissue Anchoring System, Ref: TAS), with its corresponding
sutures, both manufactured from polypropylene.
• 1 Retractable insertion guide (Ref: DPN-MNL), disposable, designed for use
in inserting the implant.
• 1 Reinforcement implant (Ref: MSAP), comprising one mesh made from
type I monolament polypropylene.
• 1 Eyed suture needle (Ref: ESN)
All Splentis components are provided sterile and ready to use.
INDICATIONS
Splentis is indicated for the surgical treatment Apical Prolapse.
CONTRAINDICATIONS
Splentis must not be used in patients:
• Undergoing anticoagulant therapy,
• With infectious processes, especially of the genital system or urinary tract,
• With vaginal, cervical, or uterine cancer,
• During pregnancy,
• With known sensitivity or allergy to polypropylene products,
• With pre-existing conditions that pose an unacceptable surgical risk,
WARNINGS
Splentis must only be used by highly trained surgeons that qualied to carry
out surgical procedures for repairing defects.
Careful patient selection and complete diagnostic evaluation are essential
prior to surgery.
Maximum precautions must be taken to avoid contamination of the implant
during the surgical procedure. As with all foreign bodies, the polypropylene
mesh and xation arms could exacerbate a pre-existing infection.
The surgical procedure must be carried out carefully, avoiding damage to
large blood vessels, nerves, and organs. Risks can be minimized by closely
observing the local anatomy and by inserting the retractable insertion guide
correctly.
It is established that the surgical technique is safe, but in the case of very
severe deviations from this and/or very marked anatomic variations, when
passing the retractable insertion guide, perforation or injury may occur to
blood vessels, organs or nerves, and repair surgery may then be necessary.
Spentis must be used with caution on patients with:
• Diabetes
• Coagulation difculties
• Obstruction of the upper urinary tract
• Renal insufciency
• Autoimmune diseases affecting connective tissue.
The patient must be warned that future pregnancies could invalidate the
surgical effects of the implant.
Splentis components are supplied sterile. Do not use the product if the
package is open or damaged.
Splentis components are designed for SINGLE use only. Therefore, DO
NOT REUSE or RESTERILIZE, since this could decrease the performance
of the device and increase the risk of improper sterilization and cross-
contamination.
It is advisable that patients avoid lifting weights, doing strenuous exercise
involving effort (cycling, running, etc.) or having sexual intercourse during
the rst four weeks after surgery.
The patient should contact the surgeon immediately in the event of:
• Dysuria
• Vaginal pain
• Fever
• Serous, bloody or purulent secretions
• Hemorrhages or other problems

PRECAUTIONS
The implant must not be handled with pointed, serrated, or sharp
objects since any damage, perforation, or tearing can cause subsequent
complications.
Maximum precautions must be taken to avoid contamination.
Avoid excessive tension on the implant during insertion.
Maximum precautionary measures must be taken when joining the TAS to
the insertion guide and to avoid exerting pressure in the wrong direction
during TAS insertion. (See point “H” of the surgical procedure)
Handling and Storage Precautions: Splentis is provided sterile and pyrogen-
free. The packaging comprises a cardboard box containing a blister pack
and four pouches: one pouch contains the reinforcement implant, the other
three contain the TAS and a blister pack containing the Retractable Insertion
Guide. IF ANY OF THE POUCHES AND/OR THE BLISTER PACK IS DAMAGED,
DO NOT IMPLANT.
Operating room conditions must meet hospital, administrative or local
government procedure.
After use, discard the product and packaging according to hospital,
administrative or local government procedure.
STORAGE
Storage of Splentis should meet the following conditions:
TEMPERATURE: Room temperature
DO NOT USE AFTER THE EXPIRY DATE SPECIFIED IN THE PACKAGING.
MAGNETIC RESONANCE (MR) ENVIRONMENT
The implant does not affect and is not affected by magnetic resonance (MR)
environments.
POSSIBLE COMPLICATIONS
Possible complications associated with the use of implant should be
discussed with the patient before surgery.
The use of a prosthesis may cause complications related to each patient’s
specic degree of intolerance to any foreign body implanted in the body.
Some complications may require removal of the implant.
Some patients may experience vaginal pain during the initial post-operative
period. Treatment with ANALGESICS and ANTI-INFLAMMATORY DRUGS may
be sufcient to relieve pain.
Other complications reported with this or other similar implants include:
• Infection.
• Mesh exposure.
• Adhesion formation.
• Vaginal pain, discomfort, irritation.
• Purulent, serous or bloody discharge.
• Inammation.
• Injuries to blood vessels or nerves.
• Presence of vaginal stula.
• Bladder instability.
• Bowel problems.
• Recurrence of prolapse.
Post operative formation of brous tissue around the implant is a normal
physiological response to the implantation of a foreign body.
In the event of vaginal exposure of the implant, generally due to infection, it
may be necessary to partially remove it.
PROMEDON requires surgeons to report any complication associated with
the use of Splentis to the Company or to the Distributor.
PATIENT INFORMATION
The surgeon is responsible for informing the patient or her representatives
before surgery about the possible complications related to the implantation
of Splentis.
The patient should be warned that future pregnancies could invalidate the
surgical effects of implanting Splentis. The patient should avoid heavy lifting
and strenuous exercise involving exertion (riding a bicycle, running, etc.) and
not have sexual relations until the doctor determines that it is appropriate to
resume normal activities.
The patient should be advised that Splentis is a permanent implant, and any
complication associated with the implant may or may not require additional
surgery to correct the complication.
The patient should contact the surgeon immediately in the event of:

• Dysuria (pain or difculty with urination)
• Vaginal pain
• Fever
• Serous, bloody or purulent discharges.
• Hemorrhages or other difculties.
• Urinary obstruction.
• Bowel problems.
SURGICAL PROCEDURE
There are different possible approaches, via the anterior or posterior vaginal
wall. In the following we shall explain the posterior approach.
The description of the technique is summarized in the following steps:
a) Patient to be in dorsal lithotomy position with legs raised and bent, under
local or general anesthetic.
b) The administration of prophylactic therapy with antibiotics should be
considered, according to the procedure approved by the hospital.
c) Insert a 12 or 14 Foley catheter in the urethra.
d) Make a lengthways incision along the posterior vaginal wall stopping 2
cm before the vaginal apex.
e) Make a blunt dissection toward the ischial spine, then identify the
coccygeal muscle and sacrospinous ligament on the right side. The same
procedure is performed on the left side
f) Touch the right ischial spine as a point of reference and determine the size
and thickness of the sacrospinous ligament.
g) To ensure correct connection of the TAS with the RIG, follow carefully the
stages described below
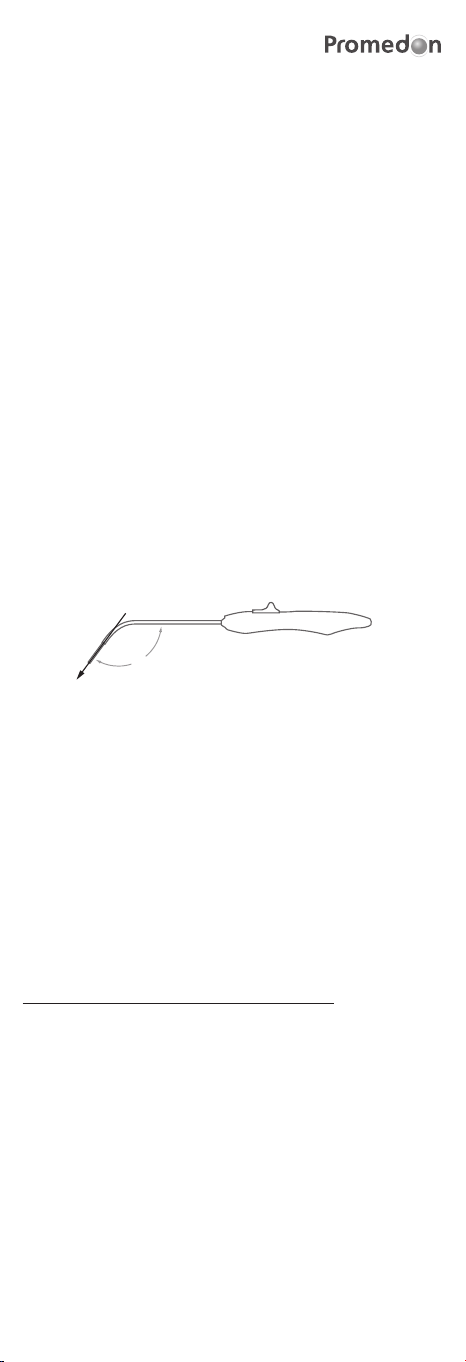
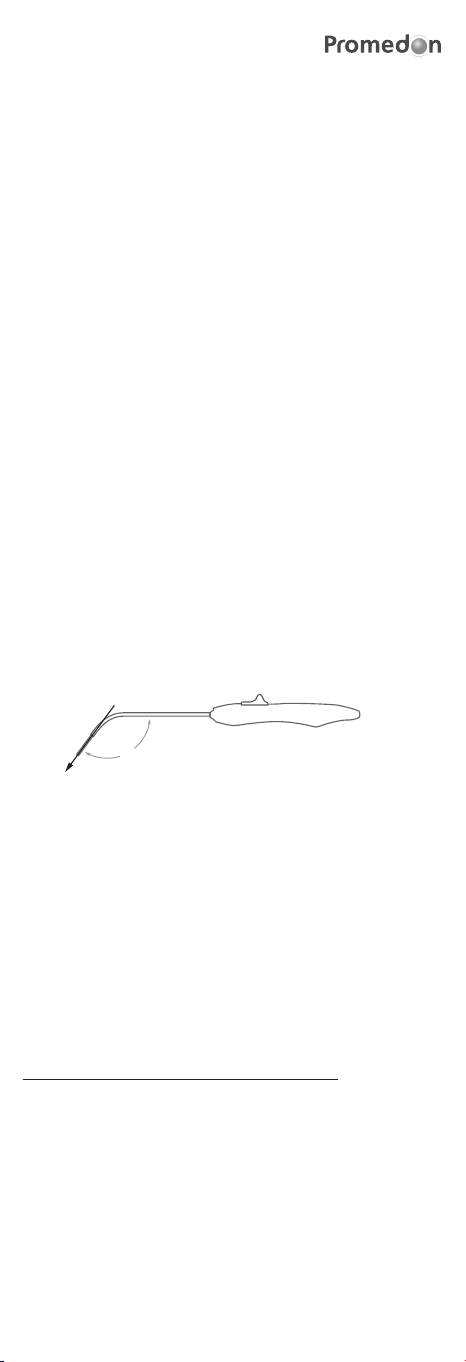
h) Insert the TAS in the anterior wall of the sacrospinous ligament 2.5 cm
medial to the ischial spine (Figure 1 shows the correct direction to apply
pressure when inserting the TAS). The surgeon should use his index nger
to touch and indentify the ligament and to guide the retractable insertion
guide to its correct implant location. The TAS should be bilaterally placed,
one in each sacrospinous ligament.
i) Once the TAS have been correctly placed, two anchor points are made
upon the vaginal apex or bilaterally in the uterosacral ligaments with TAS
sutures and eye suture needle, making sure the suture penetrates deeply so
as to avoid tearing.
Note: Use of the reinforcement implant: Instead of putting the 2 TAS sutures
through the uterosacral ligaments, the central part of the reinforcement
implant can be sutured to the uterosacral ligaments and afterwards pass
the TAS sutures through the ends of the reinforcement implants, moving it
towards the sacral spinal ligament using sliding knots.
j) The incision made in the posterior vaginal wall is closed halfway using
absorbable suture. At this point, the uterus or vaginal apex, are guided
bilaterally with the help of the index nger and a slipknot towards the
sacrospinous ligaments, avoiding excessive tension.
k) Closure of the vaginal wall is completed in the standard way.
l) Final antisepsis. Digital rectal examination and placement of a vaginal
tampon.
Postoperative care and therapy are at the surgeon’s discretion.
In case a removal of implant is required, please note:
Polypropylene mesh integrate with patient’s tissue, so complete removal may
be difcult.
In case a mesh removal is necessary due to pain, we recommend trying to
cut all the tension areas identied by the surgeon.
In most cases, the risk of organ injury caused by mesh removal may be
higher than the benets resulting from this removal, so each case should be
assessed and decided at the surgeon’s discretion.
126º
CATALOG NUMBER
LOT NUMBER
SERIAL NUMBER
CAUTION
EXPIRY DATE
DO NOT RE-USE
MANUFACTURE DATE
STERILE. STERILIZATION METHOD: ETHYLENE OXIDE
MANUFACTURER
AUTHORIZED REPRESENTATIVE IN THE EUROPEAN
COMMUNITY
CONSULT INSTRUCTIONS FOR USE
DO NOT USE IF PACKAGE IS DAMAGED
DO NOT RE-STERILIZE
KEEP AWAY FROM SUNLIGHT
KEEP DRY
SYMBOLS USED IN LABELS

INSTRUCTIONS D’UTILISATION
DESCRIPTION
Le kit Splentis comprend :
• 3 xations TAS (Tissue Anchoring System, Réf. : TAS), avec ses ls de
sutures correspondants, tous deux fabriqués en polypropylène.
• 1 guide d’introduction rétractable (Réf. : DPN-MNL), jetable, pour
introduire l’implant.
• 1 implant de renfort (Réf. : MSAP), comprenant un treillis en polypropylène
monolament macroporeux (type I).
• 1 aiguille à suture à chas (Réf. : ESN)
Tous les composants Splentis sont fournis stériles et prêts à l’emploi.
INDICATIONS
Splentis est indiqué pour le traitement chirurgical des prolapsus apicaux.
CONTRE-INDICATIONS
Splentis ne doit pas être utilisé chez les patientes :
• sous traitement anticoagulant ;
• présentant un processus infectieux, en particulier du système génital ou de
l’appareil urinaire ;
• atteintes de cancer du vagin, du col de l’utérus ou de l’utérus ;
• enceintes ;
• ayant une sensibilité ou une allergie conrmée aux produits à base de
polypropylène ;
• présentant des affections préexistantes qui impliquent un risque chirurgical
inacceptable.
AVERTISSEMENT
Splentis ne doit être utilisé que par des chirurgiens hautement qualiés en
matière d’interventions de chirurgie réparatrice.
La sélection soigneuse du patient et une évaluation complète du diagnostic
sont indispensables avant l’intervention.
Les précautions maximales doivent être prises pour éviter toute
contamination pendant la procédure chirurgicale. Comme tout corps
étranger, le treillis et les bras de xation en polypropylène peuvent exacerber
une infection préexistante.
La procédure chirurgicale doit être pratiquée avec minutie, en évitant
d’endommager les gros vaisseaux sanguins, les nerfs et les organes. Les
risques peuvent être minimisés en observant attentivement l’anatomie locale
et en introduisant le guide d’introduction rétractable correctement.
Il est établi que la technique chirurgicale est sûre, mais en cas de déviations
très sévères et/ou de variations anatomiques marquées, le passage du guide
d’introduction rétractable peut provoquer une perforation ou une blessure
des vaisseaux sanguins, des organes ou des nerfs, ce qui nécessiterait une
chirurgie réparatrice.
Splentis doit être utilisé avec prudence chez les patientes souffrant :
• de diabète,
• de problèmes de coagulation,
• d’obstruction des voies urinaires supérieures,
• d’insufsance rénale,
• de maladies auto-immunes touchant le tissu conjonctif.
La patiente doit être avisée du fait que des grossesses futures pourraient
invalider les effets chirurgicaux de l’implant.
Les composants Splentis sont fournis stériles. Ne pas utiliser le produit si
l’emballage est ouvert ou endommagé.
Les composants Splentis sont réservés à un usage UNIQUE. Par conséquent,
NE PAS RÉUTILISER ou RESTÉRILISER le produit au risque de réduire ses
performances et d’augmenter le risque de stérilisation inadéquate et de
contamination croisée.
Il est recommandé que la patiente évite de soulever des charges lourdes,
de pratiquer des activités intenses impliquant un effort (bicyclette, course
à pied, etc.) ou d’avoir des rapports sexuels au cours des quatre semaines
suivant l’intervention chirurgicale.
La patiente doit contacter le chirurgien immédiatement dans les cas suivants
:
• Dysurie
• douleur vaginale ;
• Fièvre
• Sécrétions séreuses, sanglantes ou purulentes
• Des hémorragies ou autres problèmes

PRÉCAUTIONS D’EMPLOI
L’implant ne doit pas être manipulé avec des objets pointus, dentelés ou
acérés car tout dommage, perforation ou déchirure pourrait entraîner des
complications.
Des précautions maximales doivent être adoptées pour éviter toute
contamination.
Éviter d’appliquer une tension excessive sur l’implant lors de l’insertion.
Des mesures de précaution maximales doivent être prises lors de
l’introduction du TAS dans le guide d’insertion et an d’éviter d’exercer des
pressions dans la mauvaise direction, lors de l’insertion du TAS. (Voir point «
H » de la procédure chirurgicale)
Précautions de manipulation et de stockage : Splentis est fourni stérile
et apyrogène. L’emballage comprend une boîte en carton contenant une
plaquette et quatre pochettes : l’une des pochettes contient l’implant
de renfort, les trois autres contiennent les xations TAS et la plaquette
contient le guide d’insertion rétractable. SI L’UNE DES POCHETTES ET/OU LA
PLAQUETTE EST ENDOMMAGÉE, NE PAS IMPLANTER.
Les conditions de la salle d’opération doivent être conformes aux procédures
de l’hôpital, de l’administration ou du gouvernement local.
Après l’avoir utilisé, jeter le produit et l’emballage selon la procédure de
l’hôpital, de l’administration ou du gouvernement local.
STOCKAGE
La conservation de Splentis doit respecter les conditions suivantes:
TEMPÉRATURE : Température ambiante
NE PAS UTILISER AU-DELÀ DE LA DATE DE PÉREMPTION INSCRITE SUR
L’EMBALLAGE.
ENVIRONNEMENT DE RÉSONANCE MAGNÉTIQUE (RM)
L’implant n’affecte ni n’est affecté par les environnements de résonance
magnétique (RM).
COMPLICATIONS POSSIBLES
Les complications possibles associées à l’utilisation de l’implant doivent être
présentées à la patiente avant l’intervention.
L’utilisation d’une prothèse peut entraîner des complications liées au degré
d’intolérance spécique de chaque patiente à un corps étranger implanté
dans le corps. Certaines complications peuvent exiger le retrait de l’implant.
Certains patients peuvent souffrir de douleurs vaginales dans les premiers
temps suivant l’intervention. Un traitement ANALGÉSIQUE et ANTI-
INFLAMMATOIRE peut sufre à soulager la douleur.
Les autres complications rapportées avec cet implant ou d’autres implants
similaires incluent :
• l’infection ;
• l’exposition du treillis ;
• la formation d’une adhérence ;
• des douleurs, une gêne ou une irritation vaginale ;
• Décharge purulente, séreuse ou sanguinolente.
• l’inammation ;
• Lésion de vaisseaux sanguins ou de nerfs.
• la présence d’une stule vaginale ;
• l’instabilité vésicale ;
• les problèmes de transit ;
• la réapparition du prolapsus.
La formation postopératoire de tissu breux autour de l’implant est une
réaction physiologique normale à l’implantation d’un corps étranger.
En cas d’exposition vaginale de l’implant, généralement due à une infection,
il peut être nécessaire de le retirer partiellement.
PROMEDON invite les chirurgiens à signaler au laboratoire ou au distributeur,
toute complication associée à l’utilisation de Splentis.
INFORMATION DE LA PATIENTE
Le chirurgien est tenu d’informer la patiente ou ses représentants,
préalablement à toute intervention, des complications éventuelles associées
à l’implantation de Splentis.
La patiente doit être prévenue que des grossesses futures pourraient
invalider les effets chirurgicaux de l’implantation de Splentis. La patiente
doit éviter de soulever des charges lourdes et de faire des exercices
impliquant des étirements (vélo, course à pied, etc.) ainsi que les rapports
sexuels jusqu’à ce que le médecin juge approprié de reprendre des activités
normales.
La patiente doit être avertie que Splentis est un implant permanent et que
toute complication associée à l’implant pourrait exiger, si nécessaire, une
autre intervention chirurgicale pour corriger la complication.
La patiente doit contacter le chirurgien immédiatement dans les cas suivants:
• dysurie (douleur à la miction ou difculté à uriner) ;
• douleur vaginale ;
• Fièvre
• pertes séreuses, sanguines ou purulentes ;
• hémorragies ou autres complications ;
• obstruction urinaire ;
• les problèmes de transit ;
PROCÉDURE CHIRURGICALE
Le chirurgien peut adopter deux approches différentes, par la paroi vaginale
antérieure ou par la paroi postérieure. Nous traiterons plus loin de l’approche
postérieure.
La description de la technique est résumée dans les étapes suivantes :
a) la patiente se trouve en position gynécologique dorsale, les cuisses
échies et relevées et sous anesthésie locale ou générale.
b) L’administration d’un traitement prophylactique avec des antibiotiques
doit être envisagée, selon la procédure approuvée par l’hôpital.
c) Insérer un cathéter de Foley 12 ou 14 dans l’urètre.
d) Pratiquer une incision dans le sens de la longueur le long de la paroi
vaginale postérieure jusqu’à 2 cm avant l’apex vaginal.
e) Pratiquer une dissection mousse en direction de l’épine sciatique, puis
identier le muscle coccygien et le ligament sacro-vertébral du côté droit. La
même procédure est ensuite pratiquée sur le côté gauche.
f) Toucher l’épine ischiatique droite comme point de référence et déterminer
la taille et l’épaisseur du ligament sacro-épineux.
g) An d’assurer la jonction adéquate entre le TAS et le guide d’introduction
rétractable, suivez attentivement les étapes décrites ci-dessous.
h) Insérer le TAS dans la paroi antérieure du ligament sacro-épineux à 2,5 cm
médialement par rapport à l’épine ischiatique (la gure 1 montre la direction
correcte des pressions à exercer lors de l’introduction du TAS). Le chirurgien
utilise alors son index pour toucher et identier le ligament et orienter le
guide d’insertion rétractable vers l’emplacement correct de l’implant. Le TAS
doit être placé de manière bilatérale, un sur chaque ligament sacro-épineux.
i) Une fois le TAS correctement placé, deux points d’ancrage sont pratiqués
sur l’apex vaginal ou bilatéralement sur les ligaments utérosacraux avec
les ls TAS et l’aiguille à suture à chas, en veillant à ce que le l pénètre
profondément an d’éviter un éventuel déchirement.
REMARQUE : Utilisation de l’implant de renfort : Au lieu de passer les 2
sutures TAS par les ligaments utérosacraux, la partie centrale de l’implant
de renfort peut être suturée aux ligaments utérosacraux, les dispositifs
TAS étant ensuite passés par les extrémités des implants de renfort, en les
déplaçant vers le ligament sacro-épinal à l’aide de nœuds coulissants.
j) L’incision pratiquée dans la paroi vaginale postérieure est à moitié fermée
à l’aide d’une suture à ls résorbables. À ce stade, l’utérus ou l’apex vaginal,
sont guidés bilatéralement à l’aide de l’index et d’un nœud coulant vers les
ligaments sacro-épineux, en évitant toute tension excessive.
k) Fermeture de la paroi vaginale selon la méthode standard.
l) Antisepsie nale. Toucher rectal et mise en place d’un tampon vaginal.
Les soins et le traitement postopératoires sont laissés à la discrétion du
chirurgien.
Si le retrait de l’implant est nécessaire, veuillez noter que:
Le let en polypropylène s’incorpore aux tissus de la patiente, rendant le
retrait complet potentiellement difcile.
Si le retrait du let est nécessaire en raison de la douleur, nous vous
recommandons d’essayer de couper toutes les zones de tension identiées
par le chirurgien.
Le risque d’endommager les organes en retirant le let pouvant, dans la
plupart des cas, être plus important que les avantages résultant de ce retrait,
chaque cas doit être évalué et tranché à la discrétion du chirurgien.
126º

NUMÉRO DE CATALOGUE
NUMÉRO DE LOT
NUMÉRO DE SÉRIE
ATTENTION
DATE DE PÉREMPTION
NE PAS RÉUTILISER
DATE DE FABRICATION
STÉRILE. MÉTHODE DE STÉRILISATION : OXYDE
D’ÉTHYLÈNE
FABRICANT
REPRÉSENTANT AUTORISÉ DANS LA COMMUNAUTÉ
EUROPÉENNE
CONSULTER LA NOTICE D’UTILISATION
NE PAS UTILISER SI L’EMBALLAGE EST ENDOMMAGÉ
NE PAS RESTÉRILISER
CONSERVER À L’ABRI DU SOLEIL
CONSERVER EN LIEU SEC
SYMBOLES UTILISÉS SUR LES ÉTIQUETTES

GEBRAUCHSANWEISUNG
BESCHREIBUNG
Splentis ist ein Kit mit folgendem Inhalt:
3 TAS-Anker (Tissue Anchoring System – Gewebeverankerungssystem; Bez.:
TAS), mit entsprechendem Nahtmaterial aus Polypropylen.
• 1 Herausziehbare Einschiebeführung (Bez.: DPN-MNL), für den
Einweggebrauch, zum Einsetzen des Implantats bestimmt.
• 1 Verstärkendes Implantat (Bez.: MSAP), mit einem Netz aus monolem
Polypropylen von Typ I.
• 1 Nahtnadel (Bez.: ESN)
Alle Splentis-Komponenten werden steril und einsatzbereit geliefert.
INDIKATIONEN
Splentis ist zur chirurgischen Behandlung eines apikalen Prolaps indiziert.
KONTRAINDIKATIONEN
Splentis darf in folgenden Fällen nicht bei Patienten verwendet werden:
• während einer Antikoagulationstherapie,
• bei Infektionen, insbesondere im Bereich der Geschlechtsorgane oder der
Harnwege,
• bei Vaginal-, Gebärmutterhals-, oder Gebärmutterkrebs,
• während der Schwangerschaft,
• bei bekannter Überempndlichkeit oder Allergie gegen Polypropylen-
Produkte,
• oder bei Vorerkrankungen, die ein unzumutbares chirurgisches Risiko
darstellen.
WARNHINWEISE
Splentis ist ausschließlich für den Gebrauch durch hervorragend ausgebildete
Chirurgen ausgelegt, die für die Durchführung wiederherstellender
chirurgischer Eingriffe qualiziert sind.
Vor dem chirurgischen Eingriff sind eine sorgfältige Patientenselektion und
grundlegende diagnostische Beurteilung erforderlich.
Zur Vermeidung einer Kontamination während des Eingriffs sind höchste
Sicherheitsmaßnahmen zu treffen. Wie alle Fremdkörper könnten das
Polypropylen-Netz und die Fixierungsarme bestehende Infektionen
verschlimmern.
Der chirurgische Eingriff muss mit Vorsicht ausgeführt werden, um die
großen Blutgefäße, Nerven und Organe nicht zu beschädigen. Die Risiken
können eingeschränkt werden, indem der Eingriffsbereich streng überwacht
und die herausziehbare Einschiebeführung korrekt eingesetzt wird.
Die chirurgische Technik ist unzweifelhaft sicher, aber im Fall von starken
Abweichungen davon und/oder besonders ausgeprägten anatomischen
Veränderungen kann es bei der Einführung der herausziehbaren
Einschiebeführung zu einer Perforation oder Beschädigung der Blutgefäße,
Organe oder Nerven kommen, wodurch ein wiederherstellender
chirurgischer Eingriff erforderlich wäre.
Splentis ist mit Vorsicht zu verwenden bei Patienten mit:
• Diabetes,
• Koagulationsstörungen,
• Verschluss der oberen Harnwege,
• Niereninsufzienz,
• Autoimmunerkrankungen des Bindegewebes.
Die Patientin muss darüber informiert werden, dass künftige
Schwangerschaften die chirurgische Wirkung des Implantats außer Kraft
setzen könnten.
Die Bestandteile von Splentis werden steril geliefert. Das Produkt nicht
verwenden, wenn die Verpackung geöffnet oder beschädigt ist.
Die Bestandteile von Splentis sind ausschließlich zum EINMALIGEN
Gebrauch bestimmt. Sie dürfen daher NICHT WIEDERVERWENDET
oder NEU STERILISIERT werden, da dies zu einer Beeinträchtigung der
Funktionstüchtigkeit der Vorrichtung und zur Erhöhung des Risikos einer
unzulässigen Sterilisation sowie einer Kreuzkontamination führen könnte.
Die Patienten sollten während der ersten vier Wochen nach der Operation
keine schweren Gewichte heben und anstrengende Betätigungen (z. B.
Fahrradfahren, Laufen, usw.) und Geschlechtsverkehr vermeiden.

Die Patientin muss den Chirurgen unverzüglich über das Auftreten der
folgenden Beschwerden informieren:
• Dysurie
• Vaginale Schmerzen
• Fieber
• Seröse, blutige oder eitrige Sekretionen
• Blutungen oder sonstige Beschwerden
VORSICHTSMASSNAHMEN
Das Implantat darf nicht mit spitzen, gezackten oder scharfen Gegenständen
in Berührung kommen, da jede Beschädigung, Perforation oder Rissbildung
Komplikationen mit sich bringen könnte.
Zur Vermeidung von Kontaminationen sind höchste Sicherheitsmaßnahmen
zu treffen.
Bei der Einführung darf keine übermäßige Spannung auf das Implantat
ausgeübt werden.
Beim Einführen des TAS in die Einschiebeführung sind höchste
Sicherheitsmaßnahmen zu treffen und es sollte dabei kein Druck in die
falsche Richtung ausgeübt werden. (Siehe Punkt „H“ des chirurgischen
Eingriffs)
Hinweise zur richtigen Handhabung und Aufbewahrung: Splentis wird steril
und pyrogenfrei geliefert. Die Außenverpackung aus Pappkarton enthält
eine Blisterpackung und vier Beutel. Ein Beutel enthält das verstärkende
Implantat, die anderen drei Beutel enthalten das TAS sowie eine
Blisterpackung mit der herausziehbaren Einschiebeführung. DAS IMPLANTAT
DARF NICHT VERWENDET WERDEN, WENN EINER DER BEUTEL UND/ODER
DIE BLISTERPACKUNG BESCHÄDIGT SIND.
Die Bedingungen im OP sollten den jeweiligen Vorgaben des Krankenhauses,
der Verwaltung und/oder den lokalen Vorgaben und Gesetzen entsprechen.
Nach der Benutzung entsorgen Sie das Produkt gemäß den jeweiligen
Vorgaben des Krankenhauses, der Verwaltung und/oder den lokalen
Vorgaben und Gesetzen.
AUFBEWAHRUNG
Folgende Bedingungen sind für die Lagerung von Splentis erforderlich:
TEMPERATUR: Raumtemperatur
NACH DEM AUF DER PACKUNG ANGEGEBENEN VERFALLSDATUM NICHT
MEHR VERWENDEN.
MAGNET-RESONANZ-UMGEBUNG (MR)
Das Implantat wirkt sich nicht auf Magnet-Resonanz-Umgebungen
(MR) aus, und wird in ihrer Funktionstüchtigkeit auch nicht von selbigen
beeinträchtigt.
MÖGLICHE KOMPLIKATIONEN
Mögliche Komplikationen bei der Verwendung des Implantats müssen vor
der Operation mit dem Patienten besprochen werden.
Die Verwendung einer Prothese kann zu Komplikationen führen, die
vom jeweiligen Unverträglichkeitsgrad des Patienten für den im Körper
implantierten Fremdkörper abhängen. Einige Komplikationen könnten das
Entfernen des Implantats erfordern.
Einige Patientinnen könnten während der Phase direkt nach dem Eingriff
vaginale Schmerzen verspüren. Zur Schmerzlinderung sollte eine Behandlung
mit SCHMERZSTILLENDEN und ENTZÜNDUNGSHEMMENDEN MITTELN
ausreichen.
Weitere Komplikationen in Verbindung mit diesem oder ähnlichen
Implantaten beinhalten:
• Infektionen.
• Netzexposition.
• Adhäsionsbildung.
• Vaginale Schmerzen, Beschwerden, Irritationen.
• Eitrige, seröse oder blutige Absonderungen.
• Entzündungen.
• Verletzung der Blutgefäße oder Nerven.
• Auftreten einer vaginalen Fistel.
• Blaseninstabilität.
• Darmbeschwerden.
• Wiederauftreten des Prolaps.
Die postoperative Bildung von faserigem Gewebe um das Implantat ist eine
normale physiologische Reaktion auf die Implantation eines Fremdkörpers.

Im Fall einer normalerweise auf Infektionen beruhenden vaginalen
Exposition des Implantats muss dieses gegebenenfalls teilweise entfernt
werden.
PROMEDON bittet die Ärzte darum, jede Komplikation in Verbindung
mit dem Einsatz von Splentis an Promedon bzw. den Vertriebspartner zu
melden.
INFORMATIONEN FÜR DEN PATIENTEN
Der Chirurg trägt die Verantwortung dafür, die Patientin oder ihre
Bezugsperson vor der Operation über mögliche Komplikationen zu
informieren.
Die Patientin sollte darüber informiert werden, dass künftige
Schwangerschaften die chirurgische Wirkung des Splentis-Implantats außer
Kraft setzen könnten. Die Patientin darf keine schweren Gewichte heben
und muss Tätigkeiten mit Kraftanstrengung (Rad fahren, Jogging usw.)
sowie Geschlechtsverkehr vermeiden, bis der Arzt die Wiederaufnahme der
normalen Tätigkeiten gestattet.
Die Patientin muss darauf hingewiesen werden, dass Splentis ein
Dauerimplantat ist und jegliche Komplikation in Verbindung mit dem
Implantat zusätzliche chirurgische Eingriffe zur Behebung der Komplikation
erfordern könnte.
Die Patientin muss den Chirurgen unverzüglich über das Auftreten der
folgenden Beschwerden informieren:
• Dysurie (Schmerzen oder Schwierigkeiten beim Harnlassen)
• Vaginale Schmerzen
• Fieber
• Auftreten von serösem, blutigem oder eitrigem Aususs
• Blutungen oder andere Beschwerden
• Harnwegsverstopfungen
• Darmbeschwerden.
OPERATIONSVERFAHREN
Es sind verschiedene Methoden zur Durchführung dieses Eingriffs möglich:
über die vordere oder die hintere Vaginalwand. Nachfolgend wird die
posteriore Technik erläutert:
Die Beschreibung der Technik wird in den folgenden Schritten
zusammengefasst:
a) Der Patient bendet sich in dorsaler Lithotomieposition (Rückenlage mit
hochgelagerten und angewinkelten Beinen), unter Lokal- oder Vollnarkose.
b) Die Durchführung einer prophylaktischen Antibiotikabehandlung sollte
in Betracht gezogen werden, gemäß der vom Krankenhaus genehmigten
Vorgehensweise.
c) Einen 12 oder 14 Foley-Katheter in die Harnröhre einführen.
d) In der hinteren Vaginalwand wird bis 2,0 cm vor dem vaginalen Apex ein
Längsschnitt durchgeführt.
e) Eine stumpfe Dissektion in Richtung der Spina ischiadica durchführen und
den Steißbeinmuskel und das sakrospinale Ligament auf der rechten Seite
ermitteln. Derselbe Vorgang wird auf der anderen Seite wiederholt.
f) Die rechte Spina ischiadica als Referenzpunkt berühren und die Größe und
Dicke des sakrospinalen Ligaments ermitteln.
g) Damit eine ordnungsgemäße Verbindung des TAS mit der RIG
gewährleistet ist, sind die nachfolgend aufgeführten Schritte zu befolgen:
h) Das TAS 2,5 cm zur Spina ischiadica über die vordere Wand des
sakrospinalen Ligaments einführen (In Abbildung 1 wird die Richtung
dargestellt, in die der Druck bei der Einführung des TAS ausgeübt werden
soll). Der Chirurg sollte mit dem Zeigenger das Ligament berühren
und ermitteln und die herausziehbare Einschiebeführung zur richtigen
Implantatposition bewegen. Das TAS ist beidseitig einzusetzen, eines in
jedem sakrospinalen Ligament.
i)Sobald die TAS ordnungsgemäß positioniert wurden, werden zwei
Ankerpunkte am vaginalen Apex oder bilateral in den uterosakralen
Ligamenten mit TAS-Nahtmaterial und einer Nahtnadel vorgenommen.
Dabei ist darauf zu achten, dass das Nahtmaterial tief eingeführt wird, damit
es zu keiner Rissbildung kommt.
Hinweis: Verwendung des verstärkenden Implantats: Anstelle der Einführung
126º
KATALOGNUMMER
CHARGENNUMMER
SERIENNUMMER
ACHTUNG
VERFALLSDATUM
NICHT WIEDERVERWENDEN
HERSTELLUNGSDATUM
STERIL. STERILISATIONSMETHODE: ETHYLENOXID
HERSTELLER
AUTORISIERTER VERTRETER IN DER EUROPÄISCHEN
GEMEINSCHAFT
GEBRAUCHSANWEISUNG BEACHTEN
BEI BESCHÄDIGTER PACKUNG NICHT VERWENDEN
NICHT ERNEUT STERILISIEREN
VOR SONNENLICHT SCHüTZEN
VOR FEUCHTIGKEIT SCHüTZEN
AUF DEN ETIKETTEN VERWENDETE SYMBOLE
der 2 TAS-Fäden durch die uterosakralen Ligamente kann der zentrale
Teil des verstärkenden Implantats an die uterosakralen Ligamente genäht
werden und anschließend das TAS-Nahtmaterial über die Enden des
verstärkenden Implantats passieren, dies wird dabei in Richtung des sakralen
Ligaments unter Verwendung von Rutschknoten bewegt.
j) Die in der hinteren Vaginalwand vorgenommene Inzision wird mit
resorbierbarem Nahtmaterial halb verschlossen. An dieser Stelle wird der
Uterus oder vaginale Apex bilateral mithilfe des Zeigengers und einem
Laufknoten in Richtung des sakrospinalen Ligaments begleitet, ohne dass
dabei übermäßiger Druck ausgeübt wird.
k) Der Verschluss der Vaginalwand erfolgt anhand der Standardtechnik.
l) Abschließende Antisepsis. Digital-rektale Untersuchung und Einsetzen
eines Vaginaltampons.
Die post-operative Behandlung und Therapie liegen im Ermessen des Arztes.
Im Falle einer erforderlichen Entfernung des Implantats bitte beachten:
Polypropylennetze integrieren sich in das Gewebe der Patientin, was eine
vollständige Entfernung erschweren kann.
Falls Schmerzen der Grund für eine erforderliche Entfernung des Implantats
sind, empfehlen wir, möglichst alle vom Chirurgen identizierten
Spannungsbereiche durchzuschneiden.
In den meisten Fällen kann das Risiko einer Organverletzung aufgrund einer
Netzentfernung größer sein als die Vorteile der Entfernung, sodass jeder Fall
einzeln beurteilt werden und nach dem Ermessen des Chirurgen entschieden
werden sollte.

INSTRUCCIÓN DE USO
DESCRIPCIÓN
Splentis es un kit que contiene:
• 3 Arpones TAS (Tissue Anchoring System, Ref: TAS), con sus
correspondientes suturas, ambos fabricados con polipropileno.
• 1 Guía retráctil de inserción (Ref: DPN-MNL), descartable, diseñada para
ser usada junto al implante en la colocación del mismo.
• 1 Implante de refuerzo (Ref: MSAP), que consiste en una malla de
polipropileno monolamento tipo I.
• 1 Aguja de sutura con ojal (Ref: ESN)
Todos los componentes de Splentis se proveen estériles y listos para usar.
INDICACIÓN DE USO
Splentis está indicado para el tratamiento quirúrgico del Prolapso Apical.
CONTRAINDICACIONES
Splentis no debe ser utilizado en pacientes:
• Bajo terapia con anticoagulantes,
• Con procesos infecciosos, especialmente en el sistema genital o en el
tracto urinario.
• Cáncer de vagina, cervical o uterino
• embarazadas,
• Con sensibilidad o alergia conocida a productos de polipropileno,
• Con condiciones pre-existentes que signiquen un riesgo quirúrgico
inaceptable
ADVERTENCIAS
Splentis debe ser usado solamente por cirujanos altamente capacitados y
entrenados en procedimientos quirúrgicos para la reparación de defectos.
Es esencial una cuidadosa selección de pacientes, así como también un
estudio diagnóstico completo previo a la cirugía.
Se deben tomar las máximas precauciones para evitar contaminación del
implante durante el procedimiento quirúrgico. Como todo cuerpo extraño,
el implante de polipropileno podrían potenciar una infección preexistente.
El abordaje quirúrgico se debe llevar a cabo con cuidado, evitando dañar
grandes vasos, nervios y órganos. Los riesgos se minimizan atendiendo a la
anatomía local y con el correcto pasaje de la Guía Retráctil de inserción.
Dejando establecido que la técnica quirúrgica es segura, en casos de
variaciones anatómicas muy marcadas y/o desviaciones en la técnica de
uso de la Guia retráctil de Inserción, podrían producirse perforaciones o
lesiones en los vasos sanguíneos, órganos o nervios, siendo necesaria otra
intervención quirúrgica de reparación.
Splentis se debe utilizar con precaución en pacientes con:
• Diabetes.
• Problemas de coagulación
• Obstrucción en el tracto urinario superior
• Insuciencia renal
• Enfermedades autoinmunes que afectan tejido conectivo.
La paciente debe ser advertida de que futuros embarazos podrían invalidar
los efectos quirúrgico del implante.
Los componentes de Splentis se proveen estériles. No usar el producto si el
embalaje estuviera abierto o dañado.
Los componentes de Splentis han sido diseñados para ser utilizados
sólo UNA vez. Por lo tanto, NO RE-USAR ni RE-ESTERILIZAR, ya que,
potencialmente podría perjudicar el rendimiento del dispositivo y aumentar
el riesgo de reesterilización inadecuada y contaminación cruzada.
Es conveniente que la paciente evite levantar peso, realizar ejercicios
intensos que involucren esfuerzo (andar en bicicleta, correr, etc.) y mantener
relaciones sexuales durante las primeras a cuatro semanas luego de la
cirugía.
La paciente deberá recurrir inmediatamente al Cirujano en caso de:
• Disuria
• Dolor vaginal
• Fiebre
• Presencia de secreciones serosas, sanguinolentas o purulentas
• Hemorragias u otros inconvenientes

PRECAUCIONES
El implante no debe ser manipulado con objetos puntiagudos, dentados o
losos ya que cualquier deterioro, perforación o desgarro puede ser la causa
de subsecuentes complicaciones.
Se deben tomar las máximas medidas de precaución para evitar
contaminaciones.
Deberá evitarse ejercer una tensión excesiva sobre el implante durante su
colocación.
Se deben tomar las máximas medidas de precaución en la unión del TAS con
la guía de inserción y evitar realizar la fuerza de inserción del TAS en una
dirección incorrecta. (Ver punto “H” del procedimiento quirúrgico)
Precauciones de Manipulación y Almacenamiento: Splentis se provee estéril y
libre de pirógenos. El embalaje consiste en una caja de cartón que contiene
un blister y cuatro sobres: un sobre con el implante de refuerzo, los otros
tres contienen los TAS y el blíster la Guía Retráctil de Inserción. SI ALGUNO
DE LOS SOBRES Y/O EL BLISTER ESTUVIERAN DAÑADOS, NO IMPLANTAR.
Las condiciones del quirófano deben ser de acuerdo al procedimiento
hospitalario, administrativo o gubernamental local.
Después del uso, descarte el producto y el embalaje de acuerdo al
procedimiento hospitalario, administrativo o gubernamental local.
ALMACENAMIENTO
Se aconseja almacenar Splentis bajo las siguientes condiciones:
TEMPERATURA: Ambiente
NO UTILIZAR LUEGO DE LA FECHA DE CADUCIDAD MOSTRADA EN EL
PACKAGING.
ENTORNO DE RESONANCIA MAGNÉTICA (RM)
El implante no afecta y no se ve afectado por entornos de resonancia
magnética (RM).
POSIBLES COMPLICACIONES
Las posibles complicaciones asociadas con el uso del implante deben ser
discutidas con la paciente antes de la cirugía.
El uso de una prótesis puede presentar complicaciones relacionadas al grado
de intolerancia especíco de cada paciente a cualquier cuerpo extraño
implantado en el cuerpo. Algunas complicaciones pueden requerir la
extracción del implante.
Algunas pacientes pueden experimentar dolor vaginal durante el
período post-operatorio inicial. Una terapia con ANALGÉSICOS y
ANTIINFLAMATORIOS puede ser suciente para aliviar el dolor.
Otras complicaciones reportadas con este u otros implantes similares
incluyen:
• Infección.
• Exposición de la malla
• Formación de adherencias.
• Dolor vaginal, molestia, irritación.
• Descargas purulentas, serosas o sanguíneas.
• Inamación.
• Lesiones en vasos o nervios.
• Presencia de fístula vaginal.
• Inestabilidad vesical.
• Problemas al defecar.
• Recurrencia del prolapso.
La formación post-operatoria de tejido broso alrededor del implante es una
respuesta siológica normal a la implantación de un cuerpo extraño.
En caso de exposición vaginal del implante, generalmente debida a
infección, puede ser necesario extraerlo parcialmente.
PROMEDON requiere que los Cirujanos notiquen a la Compañía o al
distribuidor sobre cualquier complicación que se desarrolle con el uso de
Splentis.
INFORMACIÓN PARA LA PACIENTE
El Cirujano tiene la responsabilidad de informar a la paciente o a sus
representantes antes de la cirugía sobre las posibles complicaciones
relacionadas con la implantación de Splentis.
La paciente debe ser advertida de que futuros embarazos podrían invalidar
los efectos quirúrgicos de la implantación de Splentis. Es conveniente que la
paciente evite levantar peso y los ejercicios intensos que involucren esfuerzo
(andar en bicicleta, correr, etc.), mantener relaciones sexuales hasta que
el médico determine cuándo es conveniente que reinicie sus actividades
normales.
La paciente debe ser advertida que Splentis es un implante permanente,
y alguna complicación asociada con el implante podría requerir o no de
cirugías adicionales de corrección de la complicación.
La paciente deberá recurrir inmediatamente al Cirujano en caso de:
• Disuria (dolor o dicultad al orinar)
• Dolor vaginal
• Fiebre
• Presencia de secreciones serosas, sanguinolentas o purulentas.
• Hemorragias u otros inconvenientes.
• Obstrucción urinaria.
• Problemas al defecar.
PROCEDIMIENTO QUIRÚRGICO
Hay distintos abordajes posibles, por la pared vaginal anterior o Posterior. A
continuación explicaremos el abordaje posterior.
La descripción de la técnica se resume en los siguientes pasos:
a) Paciente en posición de litotomía dorsal con las piernas elevadas y
exionadas, bajo anestesia regional o general.
b) Se debe considerar la administración de terapia proláctica con
antibióticos de acuerdo al procedimiento aprobado por el hospital.
c) Insertar un catéter Foley de 12 o 14 en la uretra.
d) Realizar una incisión longitudinal a lo largo de la pared vaginal posterior
hasta 2 cm de la cúpula vaginal.
e) Realizar una disección roma en dirección a la espina isquiática,
a continuación, se identican el músculo coccígeo y el ligamento
sacroespinoso del lado derecho. El mismo procedimiento se realiza en el
lado izquierdo
f) Palpar la espina isquiática derecha como punto de referencia y determinar
el tamaño y espesor del ligamento sacroespinoso.
j) Para un correcto acople de los TAS con la RIG, siga cuidadosamente los
pasos descriptos en las siguientes guras
h) Insertar los TAS en la cara anterior del ligamento sacroespinoso 2,5 cm
medial de la espina isquiática (Figura 1 se muestra la dirección correcta para
realizar la fuerza de inserción de los TAS). El cirujano utiliza su dedo índice
para tocar y reconocer el ligamento y para guiar la guía de inserción retráctil
en el lugar correcto de la implantación. Los TAS se colocan bilateralmente,
uno en cada ligamento sacroespinoso.
i) Después que los TAS estén colocados correctamente, se hacen dos puntos
de anclaje sobre la cúpula vaginal o bilateralmente en los ligamentos
uterosacros con la sutura de los TAS y la aguja de sutura con ojal,
asegurando una penetración profunda de la sutura para evitar desgarros.
Nota, Uso implante de refuerzo: En vez de pasar las 2 suturas de los TAS por
los ligamentos uterosacros se puede suturar la parte central del implante de
refuerzo a los ligamentos uterosacros y luego pasar las suturas de los TAS
por los extremos del implante de refuerzo y trasladarlo hacia el ligamento
sacro espinoso con nudos corredizos
j) Se cierra la incisión en la pared vaginal posterior hasta la mitad de la
misma con sutura absorbible. En este momento, el útero o la cúpula
vaginal, son guiadas con la ayuda del dedo índice y un nudo corredizo hacia
los ligamentos sacroespinosos bilateralmente, evitando una tensión excesiva.
k) Se completa el cierre de la pared vaginal en forma habitual.
l) Antisepsis nal. Examen rectal digital y colocación de un tampón vaginal.
Los cuidados y terapia post-operatorios quedan a criterio del Cirujano.
Nota en caso de ser necesaria una remoción del implante:
Las mallas de polipropileno se integran al tejido del paciente por lo que su
extracción total puede ser dicultosa.
En caso de requerir extraer una malla por dolor, se sugiere tratar de recortar
todas aquellas zonas de tensión detectadas por el cirujano.
En la mayoría de los casos el riesgo de lesión de órganos por la extracción de
la malla puede ser muy superior al benecio de realizar dicha extracción, por
lo que cada caso deberá ser evaluado y resuelto a discreción del cirujano.
126º

NÚMERO DE CATÁLOGO
NÚMERO DE LOTE
NÚMERO DE SERIE
PRECAUCIÓN
FECHA DE VENCIMIENTO
NO REUTILIZAR
FECHA DE FABRICACIÓN
ESTÉRIL. MÉTODO DE ESTERILIZACIÓN: ÓXIDO DE
ETILENO
FABRICANTE
REPRESENTANTE AUTORIZADO EN LA COMUNIDAD
EUROPEA
CONSULTAR LAS INSTRUCCIONES DE USO
NO UTILIZAR SI EL PAQUETE ESTÁ DAÑADO
NO REESTERILIZAR
MANTENER FUERA DE LA LUZ SOLAR
MANTENER SECO
SÍMBOLOS UTILIZADOS EN LAS ETIQUETAS

INSTRUÇÃO DE USO
DESCRIÇÃO
Splentis é um kit contendo:
• 3 âncoras TAS(Sistema de Ancoragem de Tecido, Ref: TAS), com suas
suturas correspondentes, ambas fabricadas de polipropileno.
• 1 Guia de inserção retrátil (Ref: DPN-MNL), descartável, projetado para
utilização em inserção do implante.
• 1 Implante De Reforço (Ref: MSAP), contendo uma malha de polipropileno
monolamentar tipoI.
• 1 Agulha de sutura olho (Ref: ESN)
Todos os componentes Splentis são fornecidos esterilizados e prontos para
serem utilizados.
INDICAÇÕES
Splentis é indicado para o tratamento cirúrgico do Prolapso Apical.
CONTRA-INDICAÇÕES
O Splentis não deve ser utilizado em pacientes:
• Submetidos à terapia anticoagulante,
• Com processos infecciosos, especialmente no sistema genital ou trato
urinário,
• Com câncer vaginal, cervical ou uterino,
• Durante a gestação,
• Com sensibilidade ou alergia conhecida a produtos de polipropileno,
• Com condições pré-existentes que coloquem em risco cirúrgico inaceitável,
ADVERTÊNCIAS
Splentis deve ser usado por médicos cirurgiões altamente treinados,
qualicados para realizar procedimentos cirúrgicos para curar defeitos.
Uma cuidadosa seleção de pacientes e uma avaliação diagnóstica completa
prévia à cirurgia são essenciais.
Devem ser tomadas precauções máximas para evitar a contaminação do
implante durante o procedimento cirúrgico. Como todos os corpos estranhos,
a malha de polipropileno e os braços de xação podem agravar uma infecção
pré-existente.
O procedimento cirúrgico deve ser realizado com cuidado, evitando danos a
grandes vasos sanguíneos, nervos e órgãos. Os riscos podem ser minimizados
ao observar com cautela a anatomia local, e ao inserir o guia de inserção
retrátil corretamente.
Está provado que a técnica cirúrgica é segura, mas nos casos de desvios
muito severos e/ou variações anatômicas muito acentuadas, ao passar o
guia de inserção retrátil, podem ocorrer perfurações ou ferimentos aos vasos
sanguíneos, órgãos ou nervos poderá ser necessária um cirurgia reparadora.
Spentis deve ser usado com cautela nos pacientes com:
• Diabetes
• Diculdades de coagulação
• Obstrução do trato urinário superior
• Insuciência renal
• Doenças autoimunes que afetam o tecido conectivo.
O paciente deve ser avisado que futuras gestações podem invalidar o efeitos
cirúrgicos do implante.
Os componentes Splentis são fornecidos esterilizados. Não usar o produto
caso a embalagem esteja aberta ou danicada.
Os componentes Splentis foram feitos para apenas UMA utilização. Por
essa razão, NÃO REUTILIZE nem REESTERILIZE, pois isso iria diminuir o
desempenho do dispositivo e aumentar o risco de esterilização imprópria e de
contaminação cruzada.
É aconselhável que os pacientes evitem erguer pesos, exercícios envolvendo
esforço (ciclismo, corrida, etc.) ou ter relações sexuais durante as quatro
primeiras semanas após cirurgia.
O paciente deve entrar em contato imediatamente com o médico cirurgião,
em caso de:
• Disúria
• Dor vaginal
• Febre
• Secreções serosas, com sangue ou purulenta
• Hemorragias ou outros problemas

PRECAUÇÕES
O implante não deve ser manuseado com objetos pontiagudos, serrilhados
ou aados, pois qualquer dano, perfuração ou rasgão poderá causar
complicações subsequentes.
Devem ser tomadas as máximas precauções para evitar contaminação.
Evite aplicar tensão em excesso no implante durante a inserção.
Medidas máximas de precaução devem ser tomadas quando juntar o TAS ao
guia de inserção, e para evitar exercer pressão na direção errada durante a
inserção do TAS. (Veja o ponto “H” do procedimento cirúrgico)
Precauções de Manipulação e Armazenamento: Splentis é fornecido
esterilizado e livre de pirogênio. A embalagem inclui uma caixa de papelão
com um plástico bolha e quatro bolsas: uma bolsa com o implante de
reforço, as outras três com os TAS e o plástico bolha com o Guia de Inserção
Retrátil. SE QUAISQUER UMAS DAS BOLSAS E/OU O PLÁTICO BOLHA
ESTIVEREM DANIFICADOS, NÃO REALIZE O IMPLANTE.
As condições da sala de cirurgia devem estar de acordo com os
procedimentos hospitalares, administrativos ou governamentais locais.
Depois do uso, descarte o produto e a embalagem de acordo com o
procedimento hospitalar, administrativo ou governamental local.
ARMAZENAMENTO
O armazenamento do Splentis deve cumprir as seguintes condições:
TEMPERATURA: Temperatura da Sala
NÃO UTILIZAR APÓS A DATA DE VALIDADE EXIBIDA NA EMBALAGEM.
AMBIENTE DE RESSONÂNCIA MAGNÉTICA (RM)
O implante não afeta e não é afetado por ambientes de ressonância
magnética (RM).
POSSÍVEIS COMPLICAÇÕES
As possíveis complicações associadas ao uso do implante, devem ser
discutidas com o paciente antes da cirurgia.
A utilização de uma prótese pode provocar complicações relacionadas com o
nível de intolerância especíco de cada paciente a qualquer corpo estranho
implantado no corpo. Algumas complicações podem exigir a remoção do
implante.
Algumas pacientes podem sentir dores vaginais durante o período pós-
operatório inicial. O tratamento com ANALGÉSICOS e ANTI-INFLAMATÓRIOS
pode ser suciente para aliviar a dor.
As complicações reportadas com este ou outros implantes similares incluem:
• Infecção.
• Exposição de malha.
• Formação de aderências.
• Dor vaginal, desconforto, irritação.
• Secreção serosa, com pus ou com sangue
• Inamação.
• Ferimento dos vasos sanguíneos ou nervos.
• Presença de fístula vaginal.
• Instabilidade vesical.
• Problemas intestinais.
• Recorrência de prolapso.
A formação pós-operatória de tecido broso ao redor do implante é uma
resposta siológica normal à implantação de um corpo estranho.
Em caso de exposição vaginal do implante, geralmente devido à infecção,
pode ser necessário remove-lo parcialmente.
A PROMEDON pede que os médicos cirurgiões notiquem a Empresa ou o
Distribuidor sobre qualquer complicação associada ao uso do Splentis.
INFORMAÇÃO DO PACIENTE
O cirurgião é responsável por informar os pacientes ou os seus
representantes, antes da cirurgia, sobre as possíveis complicações
relacionadas com o implante do Splentis.
O paciente deve ser avisado que futuras gestações podem invalidar o efeitos
cirúrgicos do implante Splentis. Os pacientes devem evitar erguer pesos e
exercícios intensos que envolvam esforço (andar de bicicleta, correr, etc.),
bem como relações sexuais, até que o médico determine quando seja
apropriado retomar essas atividades.
O paciente deve ser informado que o Splentis é um implante permanente,
e qualquer complicação associada a ele, pode ou não, exigir uma cirurgia
adicional para resolver as complicações.
Table of contents
Languages: