ASAHI REXEED A Series User manual

1
ENGLISH
HEMODIALYZER INSTRUCTIONS FOR USE
ASAHI REXEEDTM-A SERIES DIALYZER
1. INDICATION FOR USE
Asahi REXEEDTM-A series dialyzer (hereafter called REXEED-A) is
intended for use in hemodialysis (HD), hemodiafiltration (HDF) and
hemofiltration (HF) for the treatment of patients suffering from acute
or chronic renal failure.
2. CONTRAINDICATIONS
None known. In general, contraindications for HD, HDF and HF are
applicable.
3. ADVERSE REACTIONS
• Consult a responsible physician immediately whenever an adverse
reaction occurs.
• Some patients may experience hypersensitivity reactions during
treatment. Symptoms and signs include acute shortness of breath
with wheezing; respiratory arrest; itching; flushing; mood
discomfort; abnormal sweating; hives; generalized or localized skin
redness; edema of the face, hands, or feet; hypertension;
hypotension; elevated pulse rates; arrhythmia; ocular hyperemia;
hypoesthesia; fever; leukopenia; and thrombocytopenia.
• Side effects such as hypertension, hypotension, headache, chest pain,
stomachache, fatigue and nausea which may be associated with
hypovolemia or hypervolemia can usually be avoided by careful
management of the patient’s fluid volume and electrolyte balance as
well as the blood flow rate and transmembrane pressure (TMP).
4. WARNINGS
Follow these instructions and those of the HD machine supplier.
Improper use could cause injury or death. The manufacturer will not be
responsible for patient safety if these instructions and the HD machine
supplier instructions are not followed. Make sure these instructions are
available to the operator at the treatment site.
REXEED-A is intended for single use only. Reprocessing of
REXEED-A may lead to adverse reactions for the patient and/or
device failure.
The user must use REXEED-A before the expiration date. Refer to
the REXEED-A product label for the expiration date.
REXEED-A must be kept in a clean, dry environment away from
direct sunlight, heat, and humidity and at temperatures of 0-30°C
(32-86°F).
REXEED-A, when shipped by the manufacturer, is filled with fluid.
This fluid must not be allowed to freeze. REXEED-A with frozen
fluid must never be used, even after the thawing of the fluid.
REXEED-A is a plastic product, and must not be exposed to
vibration or impact during transportation, storage or handling.
REXEED-A must not be exposed to organic solvents such as
alcohol to prevent cracking or deformation.
Inspect each REXEED-A before use, and replace it if it shows signs
of damage, damage or improper sealing of the sterilization bag,
leakage of fluid from REXEED-A into the sterilization bag, or
misaligned or separated stoppers.
Ensure that the dialysate and blood compartments of REXEED-A
are rinsed before use according to the priming procedure described
below.
Use aseptic technique throughout priming and treatment.
Do not remove the fluid before rinsing and filling the blood
compartment with saline to prevent any air from entering
REXEED-A.
The saline must be a physiological solution that is sterile and
non-pyrogenic.
Due to its high ultrafiltration coefficient, REXEED-A must only be
used with HD machines equipped with a UF controller (Refer to the
instructions of the HD machine).
Dialysate must meet the regional or ISO water quality standards for
dialysis to minimize the risk of adverse reactions.
The use of blood and dialysate port connectors (female) attached to
blood and dialysate lines that are designed in compliance with ISO
8637:2004 and ISO 8638:2004 is recommended.
Ensure that the sensors, detectors and alarm system of the HD
machine are in proper operating condition including the venous air
sensor and the blood leak detector in accordance with the
instructions of the HD machine before starting treatment.
Ensure that air is completely purged from REXEED-A and blood
lines during priming; failure in purging air may result in blood
clotting during treatment. Further, ensure that no air enters the
patient’s blood vessel during blood return.
During priming and treatment, verify that there is no leakage from
the dialyzer, blood lines, blood ports, and their connecting parts. If
leakage is observed, replace the dialyzer or the blood lines.
If dialysate is to be used instead of saline or substitution fluid, care
must be taken to ensure that the purity of the dialysate is in
accordance with the applicable water quality standards (for example,
dialysate intended for infusion defined in ISO 11663:2009).
In the event of a problem during treatment, such as blood leakage or
coagulation, immediately discontinue the treatment under the
direction of a physician and replace REXEED-A with a new primed
dialyzer.
REXEED-A has multiple connection points. Failure to make the
proper connections can result in compromised treatment, injury, or
death due to blood or therapy fluid leak.
REXEED-A may remove medications given in the arterial blood
line. Give medications post dialyzer unless instructed otherwise.
Do not permit the TMP to exceed 500 mmHg (66 kPa) with TMP
being defined as per ISO 8637:2004.
The recommended ranges of the treatment parameters specified in
the APPENDIX should be considered when planning treatment for
patients.
Dispose the used REXEED-A and the blood lines in strict
accordance with official and institutional standards for medical
waste disposal.
5. SPECIFICATIONS & PERFORMANCE
Membrane, REXBRANETM (Polysulfone / PVP); Housing and headers,
Styrene-butadiene block copolymer; Stoppers, Polyethylene and
hydrogenated styrene-butadiene block copolymer; Potting material,
Polyurethane
Sterilized by gamma rays
Blood pathway is non-pyrogenic.
Refer to the APPENDIX for design specifications and in vitro
performance information regarding individual REXEED-A models. In
a clinical setting, the performance of REXEED-A may be different
from that in vitro; this performance may vary with the conditions and
duration of treatment.
6. ANTICOAGULATION
Anticoagulant requirements will vary with the patient’s condition; the
type, quantity, and method of anticoagulant administration should be in
accordance with the directions by a physician who is familiar with the
patient’s condition.
7. OPERATION
1. PRIMING
The order of procedures 2) and 3) can be reversed.
1) Place REXEED-A vertically in the holder, with the red header
(arterial end) down.
2) Connect the arterial blood line to the saline bag for infusion and fill
the arterial blood line completely with saline. Connect the arterial
and venous blood lines to the blood inlet and outlet ports. Be careful
not to introduce air into the hollow fibers and the blood lines. Rinse
the hollow fibers and the blood lines with at least 1000 mL saline at
approx. 100 mL/min. If any air is trapped in the dialyzer or blood
lines, introduce additional saline for rinsing while gently tapping the
dialyzer with one’s hands or pinching and releasing the blood lines
until the air is completely removed. Do not attempt to remove the
air by tapping the dialyzer with hard instruments, such as forceps,
because this may damage the dialyzer.
3) Connect the dialysate lines to the dialysate ports. Allow the
dialysate to flow at approx. 500 mL/min for 2 min or more. For
HDF, connect the substitution line to the substitution port and prime
the line.
• For HF, different priming procedure can be obtained on request.
• Instead of saline, dialysate intended for infusion may be used for
priming and ending the treatment.
2. STARTING TREATMENT
1) Connect the arterial blood line to the patient’s arterial cannula. Start
blood pump (approx. 100 mL/min) to displace saline.
2) Connect the venous blood line to the venous cannula.
• For HDF, the ultrafiltration flow rate should be monitored carefully
under the direction of a physician who is familiar with the patient’s
condition. In some patients, for example, those with a high
hematocrit value, a high ultrafiltration flow rate may cause elevation
of the blood inlet pressure.
3. ENDING TREATMENT
1) Adjust the UF flow rate and stop the blood pump.
2) Remove the arterial cannula from the patient and connect the
arterial blood line to the saline bag. Feed 100-200 mL saline into the
hollow fibers and the blood lines by starting the blood pump slowly
to rinse back patient’s blood.
3) Clamp the venous blood line and remove the venous cannula from
the patient.
8. WARRANTY AND LIMITED LIABILITY
• The manufacturer warrants that REXEED-A is manufactured in
accordance with its specifications and in compliance with ISO
9001:2008, ISO 13485:2003, applicable industry standards, and
regulatory requirements.
• If any defects caused during manufacturing or transportation are
brought to the attention of the manufacturer’s representative, the
manufacturer will replace REXEED-A with a new one through the
representative.
• The manufacturer will not be liable for any damage caused by the
reuse of REXEED-A, misuse, improper handling, non-compliance
with warnings and instructions, damage caused by events occurring
after the product is released, failure to ensure the product is in proper
condition before use, or any warranty given by independent
distributors.

2
FRANÇAIS
HÉMODIALYSEUR INSTRUCTIONS D’UTILISATION
DIALYSEUR SÉRIE ASAHI REXEEDTM-A
1. INDICATION DE MISE EN ŒUVRE
Le dialyseur Série Asahi REXEEDTM-A (désigné plus bas par REXEED-A) est
recommandé dans les cas de traitements par hémodialyse (HD), par
hémodiafiltration (HDF) et par hémofiltration (HF) pour des patients qui
présentent une insuffisance rénale aiguë ou chronique.
2. CONTRE-INDICATIONS
Aucune connue. En général, les contre-indications de l’HD, l’HDF et l’HF sont
applicables.
3. ÉVÉNEMENTS INDÉSIRABLES
• Consulter immédiatement le médecin responsable s’il se produit un événement
indésirable.
• Certains patients peuvent présenter des réactions d’hypersensibilité au cours
du traitement. Les symptômes et les signes comprennent un essoufflement
avec respiration sifflante, un arrêt respiratoire, un prurit, de l’urticaire, des
troubles de l’humeur, une transpiration anormale, des éruptions urticariennes,
une rougeur de la peau généralisée ou localisée, des œdèmes au visage, aux
mains ou aux pieds, une hypertension, une hypotension, une fréquence du
pouls élevée, une arythmie, une hyperémie oculaire, une hypoesthésie, une
fièvre, une leucopénie et une thrombocytopénie.
• Les effets secondaires à ce type d’hypertension, d’hypotension, de céphalées,
de douleur thoracique, de gastralgie, de fatigue et de nausées, accompagnant
quelquefois l’hypovolémie ou l’hypervolémie, sont généralement évitables
grâce à un contrôle soigneux du volume des fluides et de l’équilibre
électrolytique du patient, ainsi que du débit sanguin et de la pression
transmembranaire (PTM).
4. MISES EN GARDE
Suivre ces instructions et celles du fournisseur d’appareils de HD. Une utilisation
incorrecte peut provoquer des blessures ou la mort. Le fabricant ne sera pas
responsable de la sécurité des patients si ces instructions et les instructions du
fournisseur d’appareils de HD ne sont pas suivies. S’assurer que ces instructions
sont à la disposition de l’opérateur sur le lieu de traitement.
REXEED-A est réservé à un usage unique. La réutilisation de REXEED-A
peut provoquer des événements indésirables chez le patient et/ou une
défaillance du produit.
L’opérateur doit utiliser REXEED-A avant la date d’expiration. Consulter
l’étiquette de REXEED-A pour connaître la date d’expiration.
REXEED-A doit être conservé dans un endroit propre et sec, à l’abri de la
lumière directe du soleil, de la chaleur et de l’humidité, à des températures
comprises entre 0 et 30°C (32-86°F).
Lorsqu’il est expédié par le fabricant, REXEED-A renferme une solution de
remplissage. Cette solution ne doit pas être congelée. REXEED-A contenant
une solution de remplissage congelée ne doit jamais être utilisé, même après
la décongélation de la solution.
REXEED-A est un produit en matière plastique qui doit être protégé des
vibrations et des chocs pendant le transport, la conservation et la
manipulation.
REXEED-A ne doit pas être exposé à un solvant organique tel que l’alcool
afin d’éviter craquelure ou déformation.
Inspecter chaque REXEED-A avant l’emploi, et le remplacer s’il présente
des signes de détérioration, de dégradation ou d’étanchéité imparfaite de la
poche de stérilisation; une fuite de fluide de REXEED-A dans la poche de
stérilisation, défaut d’alignement ou une séparation des bouchons.
S’assurer que les compartiments du dialysat et du sang de REXEED-A sont
bien rincés avant l’utilisation, conformément à la procédure d’amorçage
décrite ci-dessous.
Utiliser une technique aseptique pendant l’amorçage et le traitement.
Ne pas retirer la solution avant de rincer et remplir le compartiment du sang
avec du sérum physiologique afin d’empêcher l’entrée d’air dans
REXEED-A.
Le sérum physiologique doit être une solution stérile et apyrogène.
Compte tenu de son coefficient d’ultrafiltration élevé, REXEED-A doit être
exclusivement utilisé sur des appareils de HD équipés d’un contrôleur d’UF
(se référer aux instructions des appareils de HD).
Le dialysat doit être conforme aux normes régionales ou ISO sur la qualité de
l’eau pour la dialyse afin de réduire le risque d’événements indésirables.
L’utilisation de raccords (femelles) pour les orifices du sang et du dialysat
fixés aux tubulures sanguines et de dialysat, fabriqués conformément aux
normes ISO 8637:2004 et ISO 8638:2004, est recommandée.
Veiller à ce que les capteurs, les détecteurs et le système d’alarme des
appareils de HD soient en bon état de fonctionnement et que le capteur d’air
veineux et le détecteur de fuite sanguine soient bien en conformité avec les
instructions des appareils de HD avant le début du traitement.
Veiller à ce que, durant l’opération d’amorçage, REXEED-A et les tubulures
sanguines soient bien purgés de tout l’air qu’ils contiennent ; faute d’une telle
précaution, il pourrait se produire un phénomène de coagulation sanguine au
cours du traitement. En outre, veiller à empêcher l’entrée d’air dans le
vaisseau sanguin du patient au cours du retour sanguin.
Durant l’amorçage et le traitement, vérifier qu’il n’y a pas de fuites du
dialyseur, des tubulures sanguines, des orifices du sang et de leurs pièces de
raccordement. En présence de fuites, remplacer le dialyseur ou les tubulures
sanguines.
Si du dialysat est utilisé à la place du sérum physiologique ou du liquide de
substitution, il faut impérativement s’assurer de sa pureté en parfait accord
avec les normes standards des eaux applicables (Par exemple, dialysat pour
réinjection défini par la norme ISO 11663:2009).
Si un problème se produisait au cours du traitement tel que, par exemple, une
fuite sanguine ou une coagulation, interrompre immédiatement le traitement
sous le contrôle d’un médecin et remplacer REXEED-A par un nouveau
dialyseur.
REXEED-A présente plusieurs points de connexion. Une connexion non
correcte peut occasionner un traitement compromis, des blessures, ou le
décès en raison d’une fuite de sang ou de liquide thérapique.
REXEED-A peut retirer des médicaments administrés dans la tubulure
sanguine artérielle. Donner des médicaments post dialyseur sauf indications
contraires.
Ne jamais laisser la PTM dépasser 500 mmHg (66 kPa), la PTM étant définie
selon la norme ISO 8637:2004.
Lors de la préparation du traitement des patients, tenir compte des plages
recommandées pour les paramètres de traitement, spécifiées dans
l’ANNEXE.
Éliminer REXEED-A et les tubulures sanguines dans le strict respect des
normes officielles et de l’établissement en matière d’évacuation des déchets
d’origine médicale.
5. SPÉCIFICATIONS ET PERFORMANCES
Membrane, REXBRANETM (polysulfone / PVP) ; boîtier et tête, copolymère
séquencé styrène/butadiène ; bouchons, polyéthylène et copolymère séquencé
styrène/butadiène hydrogéné ; matériel de remplissage, polyuréthane
Stérilisé aux rayons gamma
La voie sanfuine est apyrogène.
Consulter l’ANNEXE pour connaître les spécifications en matière de design et
les informations sur les performances in vitro des différents modèles de
REXEED-A. Dans un milieu clinique, les performances de REXEED-A peuvent
différer des performances in vitro ; ces performances peuvent varier suivant les
conditions et la durée du traitement.
6. TRAITEMENT ANTICOAGULANT
Les besoins en traitement anticoagulant peuvent varier selon l’état du patient. Le
type, la quantité et le mode d’administration du traitement anticoagulant doivent
être conformes aux prescriptions d’un médecin connaissant l’état du patient.
7. FONCTIONNEMENT
1. PROCÉDURE D’AMORÇAGE
Il est possible d’inverser les étapes 2) et 3) de la procédure.
1) Disposer REXEED-A verticalement dans le support avec la tête rouge
(extrémité artérielle) orientée vers le bas.
2) Raccorder la tubulure sanguine artérielle à la poche de sérum physiologique
pour perfusion et remplir complètement la tubulure de sang artérielle de
sérum physiologique. Raccorder les tubulures sanguines artérielle et veineuse
respectivement aux orifices d’entrée et de sortie du sang. Veiller à ne pas
introduire d’air dans les fibres creuses ou les tubulures sanguines. Rincer les
fibres creuses et les tubulures sanguines avec au moins 1000 mL de sérum
physiologique à une vitesse de 100 mL/min environ. Si de l’air est
emprisonné dans le dialyseur ou les tubulures sanguines, introduire du sérum
physiologique de rinçage tout en tapotant le dialyseur d’une main ou en
pinçant et relâchant les tubulures sanguines jusqu’à ce que l’air soit
complètement éliminé. Ne pas essayer d’éliminer l’air en tapant sur le
dialyseur avec des instruments durs, tels que des pinces, car cela pourrait
endommager le dialyseur.
3) Raccorder les tubulures du dialysat aux orifices du dialysat. Laisser couler le
dialysat à la vitesse de 500 mL/min environ pendant au moins deux minutes.
En HDF, connecter la tubulure de réinjection au port de réinjection et
amorcer la tubulure.
• Une procédure différente d’amorçage pour l’HF peut être obtenue sur
demande.
• À la place du sérum physiologique, le dialysat pour réinjection peut-être
utilisé au cours de la procédure d’amorçage ou dans la phase terminale du
traitement.
2. DÉBUT DU TRAITEMENT
1) Raccorder la tubulure sanguine artérielle à la canule artérielle du patient.
Démarrer la pompe sanguine (100 mL/min environ) pour évacuer le sérum
physiologique.
2) Raccorder la tubulure sanguine veineuse à la canule veineuse.
• Pour l’HDF, le débit d’ultrafiltration doit être surveillé avec attention, sous le
contrôle d’un médecin connaissant l’état du patient. Chez certains patients, par
exemple chez les patients ayant une valeur d’hématocrite élevée, un débit
d’ultrafiltration élevé peut entraîner une augmentation de la pression d’entrée
du sang.
3. FIN DU TRAITEMENT
1) Régler le débit d’ultrafiltration et interrompre la pompe sanguine.
2) Déconnecter la ligne artérielle du patient et raccorder la tubulure sanguine
artérielle à la poche de sérum physiologique. Remplir les fibres creuses et les
tubulures sanguines avec 100 à 200 mL de sérum physiologique en démarrant
la pompe sanguine lentement afin de rincer le retour veineux du patient.
3) Clamper la tubulure sanguine veineuse et déconnecter la ligne veineuse du
patient.
8. GARANTIE ET LIMITE DE RESPONSABILITÉ
• Le fabricant garantit que REXEED-A est fabriqué selon les spécifications et
conformément aux normes ISO 9001:2008, ISO 13485:2003 et à celles en
vigueur dans l’industrie, de même qu’aux exigences réglementaires.
• Tout défaut résultant de la fabrication ou du transport signalé au distributeur
du fabricant, entraînera la mise à disposition par celui-ci d’un nouveau
REXEED-A en remplacement du matériel défectueux.
• Le fabricant décline toute responsabilité en cas de dommage consécutif à une
réutilisation de REXEED-A, à leur mauvais usage, et des manipulations
incorrectes ainsi qu’au non-respect de ses mises en garde et instructions, en
cas de dommage dû à une cause postérieure à la délivrance du produit, de
non-vérification du bon état du produit avant sa mise en œuvre, ou de toute
garantie donnée par des distributeurs indépendants.

3
DEUTSCH
HÄMODIALYSATOR GEBRAUCHSANWEISUNG
ASAHI REXEEDTM-A SERIE DIALYSATOR
1. ANWENDUNGSGEBIET
Der Dialysator der Asahi REXEEDTM-A Serie (nachstehend REXEED-A
genannt) ist für die Behandlung von Patienten mit akutem oder chronischem
Nierenversagen im Rahmen der Hämodialyse (HD), Hämodiafiltration (HDF)
sowie Hämofiltration (HF) bestimmt.
2. KONTRAINDIKATIONEN
Keine bekannt. Im Allgemeinen gelten die Gegenanzeigen für HD, HDF und HF.
3. NEBENWIRKUNGEN
• Ziehen Sie sofort einen verantwortlichen Arzt zu Rate, wenn Nebenwirkungen
auftreten sollten.
• Bei einigen Patienten kann es während der Behandlung zu
Überempfindlichkeitsreaktionen kommen. Zu den Symptomen und Anzeichen
gehören: akute Atemnot mit keuchenden Atemgeräuschen, Atemstillstand,
Juckreiz, Hitzewallungen, Veränderung der Stimmungslage, übermäßiges
Schwitzen, Urtikaria, generalisierte oder lokalisierte Hautrötung, Ödeme im
Gesicht, an Händen oder Füßen, Hypertonie, Hypotonie, Erhöhung der
Pulsfrequenz, Arrhythmie, Hyperämie des Auges, Hypoästhesie, Fieber,
Leukopenie und Thrombozytopenie.
• Nebenwirkungen wie Hypertonie, Hypotonie, Kopfschmerzen,
Brustschmerzen, Bauchschmerzen, Müdigkeit und Übelkeit, die mit einer
Hypovolämie oder Hypervolämie verbunden sind, können im Allgemeinen
durch eine sorgfältige Kontrolle des Flüssigkeits- und Elektrolythaushaltes
des Patienten, der Blutflussrate und des Transmembrandrucks (TMD)
vermieden werden.
4. WARNHINWEISE
Befolgen Sie diese Gebrauchsanweisung sowie die Hinweise des
HD-Geräteherstellers. Bei unsachgemäßer Verwendung droht Verletzungs- bzw.
Lebensgefahr. Der Hersteller übernimmt bei Nichtbeachtung dieser
Gebrauchsanweisung bzw. der Anweisungen des HD-Geräteherstellers keine
Haftung für die Sicherheit des Patienten. Diese Gebrauchsanweisung muss dem
Bedienpersonal am Behandlungsort vorliegen.
REXEED-A ist nur für den einmaligen Gebrauch bestimmt. Die
Aufbereitung des REXEED-A kann zu Nebenwirkungen für den Patienten
und/oder zum Versagen des Produkts führen.
Der Anwender muss den REXEED-A vor Ablauf des Verfallsdatums
verwenden. Das Verfallsdatum kann dem Produktetikett des REXEED-A
entnommen werden.
REXEED-A ist bei einer Temperatur von 0-30°C (32-86°F) in einer sauberen
und trockenen Umgebung und vor direktem Sonnenlicht, Hitze und
Feuchtigkeit geschützt, aufzubewahren.
REXEED-A ist beim Versand mit Flüssigkeit gefüllt. Das Gefrieren des
Filters ist daher zu vermeiden. Sollte Flüssigkeit im REXEED-A gefroren
sein, darf der Hämodialysefilter niemals verwendet werden, d.h. auch nicht
nach dem Auftauen der Flüssigkeit.
REXEED-A besteht aus Kunststoff und darf während Transport, Lagerung
und Handhabung weder Vibrationen noch Stößen ausgesetzt werden.
REXEED-A darf keinen organischen Lösungsmitteln wie zum Beispiel
Alkohol ausgesetzt werden, um Risse und Verformungen zu vermeiden.
Untersuchen Sie jeden REXEED-A vor dem Gebrauch und ersetzen Sie
Filter, die Anzeichen von Beschädigung aufweisen, bei denen die sterile
Verpackung beschädigt oder nicht richtig versiegelt ist, wenn Flüssigkeit aus
dem REXEED-A in die sterile Verpackung ausgetreten ist oder wenn die
Verschlusskappen nicht oder nicht richtig auf den Anschlüssen sitzen.
Stellen Sie sicher, dass die Dialysat- und Blutkompartimente des
REXEED-A vor dem Gebrauch entsprechend den nachfolgenden
Anweisungen vorbereitet und gespült werden.
Verwenden Sie sterile Arbeitstechniken während Vorbereitung, Spülung, und
Behandlung.
Entfernen Sie die Flüssigkeit nicht, bevor die Blutseite des REXEED-A
gespült und mit Kochsalzlösung gefüllt ist, um jegliches Eindringen von Luft
in den REXEED-A zu verhindern.
Die Kochsalzlösung muss eine physiologische Lösung sein, die steril und
nicht pyrogen ist.
Aufgrund seiner hohen Ultrafiltrationskoeffizienten darf REXEED-A nur mit
HD-Geräten verwendet werden, die mit einem UF-Regler versehen sind
(siehe hierzu die Anweisungen des HD-Geräts).
Das Dialysat muss dem regionalen oder ISO Qualitätsstandard von Wasser
für die Dialyse entsprechen, um das Risiko von Nebenwirkungen zu
minimieren.
Die Verwendung von Blut- und Dialysat-Anschlussstücken (weiblich),
angeschlossen an Blut- und Dialysatschläuche, die ISO 8637:2004 und ISO
8638:2004 entsprechen, wird empfohlen.
Stellen Sie vor Beginn der Behandlung sicher, dass sich die Sensoren,
Detektoren und Alarmsysteme des HD-Geräts in einem ordnungsgemäßen,
betriebsbereiten Zustand befinden, einschließlich des venösen Luftsensors
und des Blutaustrittdetektors; folgen Sie hierzu den Anweisungen des
HD-Geräteherstellers.
Stellen Sie sicher, dass REXEED-A und die Blutschläuche während der
Vorbereitung und Spülung vollständig entlüftet worden sind, da es bei
unzureichender Entlüftung während der Behandlung zur Bildung von
Blutgerinnseln kommen kann. Stellen Sie weiterhin sicher, dass während der
Blutrückgabe in das Gefäßsystem des Patienten keine Luft eindringen kann.
Vergewissern Sie sich, dass während des Spülens und der Behandlung der
Dialysator, die Blutschläuche, die Blutanschlüsse und ihre Verbindungsteile
kein Leck aufweisen. Wenn ein Leck gefunden wird ist der Dialysator
beziehungsweise sind die Blutschläuche zu ersetzen.
Falls Dialysat an Stelle von Kochsalzlösung oder Ersatzflüssigkeit eingesetzt
wird ist darauf zu achten, dass die Wasserqualität den örtlichen
Wasserqualitätsstandards entspricht (zum Beispiel Dialysat, das zur Infusion
bestimmt ist gemäß Definition nach ISO 11663:2009).
Sollte es während der Behandlung zu einem Problem kommen, wie zum
Beispiel Austritt von Blut oder Blutgerinnung, muss die Behandlung sofort
unter Aufsicht eines Arztes abgebrochen und der REXEED-A gegen einen
neuen, vorbereiteten und gespülten Dialysator ausgetauscht werden.
REXEED-A weist mehrere Anschlussstellen auf. Der inkorrekte Anschluss
des Geräts kann zu Blutverlust oder Verlust von Therapieflüssigkeit führen,
was die Behandlung beeinträchtigt bzw. Verletzungen oder sogar den Tod
zur Folge haben kann.
REXEED-A entfernt eventuell Medikamente die über den arteriellen
Blutschlauch verabreicht werden. Sofern nicht anders angeordnet sind solche
Medikamente nach dem Dialysator zu verabreichen.
Der TMD darf 500 mmHg (66 kPa) nicht übersteigen, bei Definition des
TMD gemäß ISO 8637:2004.
Die im ANHANG angegebenen empfohlenen Bereiche für die
Behandlungsparameter sollten bei der Planung der Behandlung von Patienten
berücksichtigt werden.
Die Entsorgung des REXEED-A und deren Blutschläuche muss unter
genauer Einhaltung der geltenden Vorschriften und Richtlinien der
Einrichtung im Hinblick auf die Entsorgung von medizinischem Abfall
durchgeführt werden.
5. TECHNISCHE DATEN & LEISTUNG
Membran, REXBRANETM (Polysulfon / PVP); Gehäuse und Endkappen,
Styrol-Butadien-Blockcopolymer; Verschlusskappen, Polyethylen und hydriertes
Styrol-Butadien-Blockcopolymer; Vergussmaterial, Polyurethan
Sterilisation durch Gammabestrahlung
Der Blutdurchgang ist nicht pyrogen.
Im ANHANG finden Sie die technischen Daten und Informationen zu
In-vitro-Ergebnissen der einzelnen REXEED-A-Modelle. In einer klinischen
Situation kann die Leistung von REXEED-A von der Leistung In vitro
abweichen. Diese Leistung kann abhängig von den Bedingungen und der Dauer
der Behandlung variieren.
6. ANTIKOAGULATION
Der Bedarf an Antikoagulantien schwankt in Abhängigkeit vom Zustand des
Patienten. Die Art und Menge der verabreichten Antikoagulantien sowie die
entsprechende Darreichungsform sollten daher durch einen mit dem Zustand des
Patienten vertrauten Arzt festgelegt werden.
7. VORGEHENSWEISE
1. VORBEREITUNG, SPÜLEN
Die Reihenfolge der Vorgänge 2) und 3) kann umgekehrt werden.
1) Platzieren Sie den REXEED-A vertikal in der Halterung, so dass die rote
Endkappe (arterielles Ende) nach unten zeigt.
2) Schließen Sie den arteriellen Blutschlauch an den Beutel mit der
physiologischen Kochsalzlösung an und füllen Sie ihn vollständig. Schließen
Sie den arteriellen Blutschlauch an die Bluteinlassöffnung und den venösen
Blutschlauch an die Blutauslassöffnung an. Gehen Sie vorsichtig vor, damit
keine Luft in die Hohlfasern und die Blutschläuche gelangt. Spülen Sie die
Hohlfasern und die Blutschläuche mit mindestens 1000 mL Kochsalzlösung
bei einer Flussrate von ca. 100 mL/min. Wenn Luft im Dialysator oder den
Blutschläuchen eingeschlossen ist, führen Sie weitere Kochsalzlösung zum
Spülen zu und klopfen Sie dabei sanft mit den Händen auf den Dialysator
oder drücken Sie die Blutschläuche wiederholt zusammen, bis die Luft
vollständig entwichen ist. Klopfen Sie nicht mit harten Instrumenten wie z. B.
Klemmen auf den Dialysator, um die Luft zu entfernen, da dies den
Dialysator beschädigen könnte.
3) Schließen Sie die Dialysatleitungen an die Dialysatanschlüsse an. Lassen Sie
das Dialysat mindestens 2 Minuten mit einer Flussrate von ca. 500 mL/min
durchlaufen. Bei HDF verbinden Sie die Ersatzleitung mit dem
Ersatzanschluss und spülen Sie den Schlauch.
• Davon abweichende Anweisungen zur Vorbereitung und zum Spülen bei HF
sind auf Anfrage erhältlich.
• Anstelle von Kochsalzlösung kann Dialysat, das zur Infusion bestimmt ist zur
Vorbereitung, Spülung und Beendigung der Behandlung verwendet werden.
2. BEGINN DER BEHANDLUNG
1) Schließen Sie den arteriellen Blutschlauch an die arterielle Kanüle des
Patienten an. Setzen Sie die Blutpumpe in Gang (ca. 100 mL/min) und lassen
Sie die Kochsalzlösung ablaufen.
2) Schließen Sie den venösen Blutschlauch an die venöse Kanüle an.
• Bei HDF muss die Flussrate der Ultrafiltration unter Anleitung eines Arztes,
der mit dem Gesundheitszustand des Patienten vertraut ist, sorgfältig
überwacht werden. Bei manchen Patienten, beispielsweise jenen mit einem
hohen Hämatokritwert, kann eine hohe Ultrafiltrationsflussrate einen Anstieg
des Eingangsblutdrucks hervorrufen.
3. ENDE DER BEHANDLUNG
1) Stellen Sie die UF-Flussrate auf einen geeigneten Wert ein und stellen dann
die Blutpumpe ab.
2) Entfernen Sie die arterielle Kanüle vom Patienten und schließen den
arteriellen Blutschlauch an den Beutel mit der physiologischen
Kochsalzlösung an. Lassen Sie 100-200 mL Kochsalzlösung durch Betätigen
der Blutpumpe in die Hohlfasern und Blutschläuche laufen, so dass das Blut
langsam in den Patienten zurückfließen kann.
3) Klemmen Sie den venösen Blutschlauch ab und entfernen Sie die venöse
Kanüle vom Patienten.
8. GARANTIE UND HAFTUNGSBESCHRÄNKUNG
• Der Hersteller garantiert, dass REXEED-A gemäß den
Qualitätsanforderungen entsprechend ISO 9001:2008, ISO 13485:2003, sowie
entsprechend den anwendbaren Industriestandards und weiteren Vorschriften
der Aufsichtsbehörden hergestellt wurde.
• Bitte informieren Sie den zuständigen Vertreter des Herstellers über
eventuelle Produktions-oder transportbedingte Schäden. Der Hersteller leistet
in diesem Fall über den zuständigen Vertreter Ersatz für den defekten
REXEED-A.
• In den folgenden Fällen kann der Hersteller nicht für eventuelle Ansprüche
haftbar gemacht werden: Schäden, die durch Wiederverwendung von
REXEED-A, Missbrauch oder durch fehlerhafte Verwendung entstanden sind;
Schäden, die durch die Missachtung von Warnhinweisen und
Vorsichtsmaßnahmen entstanden sind; Schäden, die durch nach der Freigabe
des Produkts auftretende Ereignisse verursacht wurden; Schäden, die durch
eine Prüfung des Zustands des Produkts vor der Verwendung vermeidbar
gewesen wären; Gewährleistungen, die durch unabhängige
Vertriebsorganisationen abgegeben wurden.

4
ITALIANO
EMODIALIZZATORE ISTRUZIONI PER L’USO
DIALIZZATORE ASAHI – SERIE REXEEDTM-A
1. INDICAZIONI D’USO
Il dializzatore Asahi della serie REXEEDTM-A (d’ora in avanti:
REXEED-A) è indicato per l’emodialisi (HD), l’emodiafiltrazione (HDF) e
l’emofiltrazione (HF) nel trattamento di pazienti affetti da insufficienza
renale acuta o cronica.
2. CONTROINDICAZIONI
Nessuna nota. In generale, valgono le controindicazioni relative all’HD,
HDF e HF.
3. REAZIONI AVVERSE
• In caso di comparsa di reazioni avverse, consultare immediatamente il
medico curante.
• Alcuni pazienti possono sviluppare reazioni da ipersensibilità durante il
trattamento. Segni e sintomi includono tachipnea acuta con dispnea
sibilante; arresto respiratorio; prurito; arrossamento; alterazioni
dell’umore; iperidrosi; orticaria; arrossamento cutaneo localizzato o
generalizzato; edema al viso, mani o piedi; ipertensione; ipotensione;
tachicardia, aritmia; iperemia oculare; ipoestesia; febbre; leucopenia e
trombocitopenia.
• L’insorgenza di effetti collaterali quali ipertensione, ipotensione, cefalea,
dolore toracico, gastralgia, spossatezza e nausea, potenzialmente
associati a ipovolemia o ipervolemia, è in genere prevenibile mediante
l’accurata gestione dei fluidi corporei del paziente, del bilancio
elettrolitico del paziente così come della velocità del flusso ematico e
della pressione transmembrana (PTM).
4. AVVERTENZE
Seguire queste istruzioni e quelle del fornitore dell’apparecchio per HD.
L'uso improprio potrebbe causare il ferimento o la morte. Il produttore
declina ogni responsabilità sulla sicurezza del paziente in caso di mancata
osservanza di queste istruzioni e delle istruzioni del fornitore
dell’apparecchio per HD. Assicurarsi che queste istruzioni siano a
disposizione dell'operatore nel luogo del trattamento.
REXEED-A è un dispositivo monouso. La rigenerazione del prodotto
REXEED-A può comportare reazioni avverse per il paziente e/o guasto
del dispositivo medico stesso.
REXEED-A deve essere usato prima della data di scadenza. Per la data
di scadenza fare riferimento all’etichetta del prodotto REXEED-A.
REXEED-A deve essere conservato in un luogo pulito e asciutto, al
riparo dalla luce solare diretta, da fonti di calore e dall’umidità, a
temperature comprese tra 0 e 30°C (32-86°F).
REXEED-A è fornito dal produttore riempito di fluido. Tale fluido non
deve essere sottoposto a congelamento. REXEED-A non deve mai
essere utilizzato in caso di congelamento del fluido, anche dopo lo
scongelamento dello stesso.
REXEED-A, realizzato in plastica, non deve essere esposto a vibrazioni
o subire urti durante il trasporto, la conservazione o la manipolazione.
REXEED-A non deve venire a contatto con solventi organici, come
l’alcol, per prevenire incrinature o deformazioni.
Controllare ogni REXEED-A prima dell’uso e sostituirlo se si
riscontrano segni di danni, danni o imperfezioni nella sigillatura della
sacca di sterilizzazione, perdite di liquido dal REXEED-A nella sacca di
sterilizzazione, allineamento scorretto o separazione dei tappi.
Assicurarsi che i compartimenti ematico e dialisato di REXEED-A
vengano sciacquati prima dell’uso secondo la procedura di riempimento
descritta di seguito.
Effettuare il riempimento ed il trattamento in condizioni di asepsi.
Non togliere il fluido prima di aver risciacquato e riempito il
compartimento ematico con soluzione salina per impedire l’ingresso di
aria nel REXEED-A.
La soluzione salina deve essere una soluzione fisiologica, sterile ed
apirogena.
A causa del suo alto coefficiente di ultrafiltrazione, REXEED-A deve
essere utilizzato solamente con apparecchi per HD dotati di controllo
UF (far riferimento alle istruzioni dell’apparecchio per HD).
Il dialisato deve essere conforme agli standard di qualità locali o ISO
relativi all'acqua per dialisi al fine di minimizzare il rischio di reazioni
avverse.
Si raccomanda che i raccordi (femmine) utilizzati per la connessione
delle porte ematiche e dialisato alle linee sangue e dialisato siano
realizzati in conformità alle norme ISO 8637:2004 e ISO 8638:2004.
Prima di iniziare il trattamento, assicurarsi che i sensori, i rilevatori e il
sistema di allarme della apparecchio per HD siano in condizioni
operative appropriate, incluso il sensore aria venosa e il rilevatore
perdite sangue, in accordo con le istruzioni dell’apparecchio per HD.
Assicurarsi che durante il riempimento l’aria venga completamente
rimossa da REXEED-A e dalle linee sangue; la mancata rimozione
dell’aria residua può comportare la formazione di coaguli durante il
trattamento. Assicurarsi inoltre che durante la restituzione del sangue
non venga introdotta aria nel vaso ematico del paziente.
Durante il riempimento ed il trattamento, verificare che non vi siano
perdite dal dializzatore, dalle linee sangue e dai relativi raccordi. In caso
di perdite, sostituire il dializzatore o le linee sangue.
Qualora il dialisato venga utilizzato al posto della soluzione salina o del
liquido di sostituzione, prestare particolare attenzione affinchè la
purezza del dialisato sia garantita nel rispetto dei relativi standard sulla
qualità delle acque (ad esempio, dialisato indicato per infusione secondo
quanto definito dalle norme ISO 11663:2009).
In caso di problemi durante il trattamento, quali perdite di sangue o
formazione di coaguli, interrompere immediatamente il trattamento
sotto il controllo di un medico e sostituire REXEED-A con un nuovo
dializzatore riempito.
REXEED-A ha molteplici punti di connessione. La mancata esecuzione
delle connessioni adeguate può comportare problemi al trattamento,
ferimento o morte dovuta alla perdita di sangue o fluido terapeutico.
REXEED-A potrebbe rimuovere i farmaci immessi nella linea sangue
arteriosa. Durante il trattamento dialitico i farmaci devono essere
immessi nel circuito venoso dopo il dializzatore eccetto nel caso venga
prescritto diversamente.
La PTM non deve superare i 500 mmHg (66 kPa), con la PTM definita
secondo gli standard ISO 8637:2004.
Tenere conto degli intervalli raccomandati per i parametri di trattamento
specificati nell’APPENDICE al momento della programmazione del
trattamento per i pazienti.
Smaltire il dispositivo REXEED-A usato e le linee sangue osservando
rigorosamente le normative ufficiali e istituzionali per i rifiuti sanitari
speciali.
5. SPECIFICHE E PRESTAZIONI
Membrana, REXBRANETM (Polisulfone / PVP); Housing e testate,
copolimero a blocchi stirene-butadiene; Tappi, polietilene e copolimero a
blocchi stirene-butadiene idrogenato; Materiale potting, poliuretano
Sterilizzato a raggi gamma
Il compartimento ematico è apirogeno.
Consultare l’APPENDICE per le specifiche di design e informazioni sulle
prestazioni in vitro dei singoli modelli di REXEED-A. In un setting clinico,
il rendimento di REXEED-A potrebbe essere diverso da quello in vitro; tale
rendimento potrebbe variare in base alle condizioni e alla durata del
trattamento.
6. ANTICOAGULANTE
I requisiti previsti per l’anticoagulante variano in funzione delle condizioni
del paziente; tipo, quantità e metodo di somministrazione
dell’anticoagulante devono essere indicati da un medico che conosce bene il
quadro clinico del paziente.
7. FUNZIONAMENTO
1. RIEMPIMENTO
L’ordine delle procedure 2) e 3) può essere invertito.
1) Posizionare REXEED-A verticalmente sul sostegno, con la testata rossa
(estremità arteriosa) verso il basso.
2) Collegare la linea sangue arteriosa alla sacca di soluzione salina per
infusione e riempire completamente la linea sangue arteriosa di
soluzione salina. Collegare le linee sangue arteriosa e venosa
rispettivamente alle porte di entrata e uscita del sangue. Fare attenzione
a non introdurre aria nelle fibre cave e nelle linee sangue. Sciacquare le
fibre cave e le linee sangue con almeno 1000 mL di soluzione salina,
fatti scorrere a circa 100 mL/min. Se dell'aria rimane intrappolata nel
dializzatore o nelle linee sangue, introdurre altra soluzione salina per
risciacquare dando leggeri colpetti al dializzatore con la mano oppure
stringendo e rilasciando le linee sangue finché l'aria non è stata rimossa
completamente. Evitare di eliminare l’aria colpendo il dializzatore con
strumenti rigidi, quali le pinze, poiché si potrebbe danneggiare il
dializzatore.
3) Collegare le linee del dialisato alle porte del dialisato. Far fluire il
dialisato alla velocità di 500 mL/min circa per almeno 2 minuti. Per il
trattamento di HDF, connettere la linea del liquido di sostituzione alla
porta per il liquido di sostituzione e riempire la linea.
• Su richiesta si può ottenere una procedura di riempimento diversa per
l’HF.
• Per il riempimento e la fine del trattamento, può essere utilizzato
dialisato indicato per infusione al posto della soluzione salina.
2. INIZIO DEL TRATTAMENTO
1) Collegare la linea sangue arteriosa alla cannula arteriosa del paziente.
Attivare la pompa ematica (circa 100 mL/min) per sostituire la
soluzione salina.
2) Collegare la linea sangue venosa alla cannula venosa.
• Per l’HDF, la velocità di ultrafiltrazione deve essere monitorata
attentamente da un medico che conosca bene le condizioni del paziente.
In alcuni pazienti, ad esempio in quelli che presentano un valore di
ematocrito elevato, una velocità di ultrafiltrazione elevata potrebbe
indurre un aumento della pressione del sangue in entrata.
3. TERMINE DEL TRATTAMENTO
1) Regolare il flusso UF e arrestare la pompa ematica.
2) Rimuovere la cannula arteriosa dal paziente e collegare la linea sangue
arteriosa alla sacca di soluzione salina. Avviando la pompa ematica
lentamente, immettere 100-200 mL di soluzione salina nelle fibre cave e
nelle linee sangue, per effettuare il lavaggio di ritorno del sangue del
paziente.
3) Clampare la linea sangue venosa ed estrarre l’agocannula venosa dal
paziente.
8. GARANZIA E LIMITAZIONI DI RESPONSABILITÀ
• Il produttore garantisce che REXEED-A è prodotto secondo le specifiche
proprie ed in conformità alle norme ISO 9001:2008, ISO 13485:2003,
agli standard industriali applicabili e alle disposizioni vigenti.
• Qualsiasi difetto imputabile alla fabbricazione o al trasporto venga
segnalato all’attenzione del rappresentante del produttore, il produttore
sostituirà, tramite il proprio rappresentante, il REXEED-A difettoso con
uno nuovo.
• Il produttore declina ogni responsabilità per i danni causati dal riutilizzo
di REXEED-A, dalla cattiva manipolazione o dall’uso improprio, dalla
mancata osservanza delle avvertenze e delle istruzioni, per i danni
verificatisi dopo la distribuzione del prodotto, per quelli imputabili alla
mancata verifica delle condizioni del prodotto prima dell’uso o connessi
ad eventuali garanzie offerte da distributori indipendenti.

5
ESPAÑOL
HEMODIALIZADOR INSTRUCCIONES DE USO
DIALIZADOR DE LA SERIE REXEEDTM-A DE ASAHI
1. INDICACIONES DE EMPLEO
El dializador Asahi de la serie REXEEDTM-A (llamado de aquí en adelante
el REXEED-A) está indicado para usarse en el tratamiento con hemodiálisis
(HD), hemodiafiltración (HDF) y hemofiltración (HF) en pacientes que
sufren de insuficiencia renal aguda o crónica.
2. CONTRAINDICACIONES
Ninguna conocida. En general, son aplicables las contraindicaciones
referentes a la HD, HDF y HF.
3. EFECTOS ADVERSOS
• Consulte inmediatamente con el médico responsable si se produce un
efecto adverso.
• Algunos pacientes pueden experimentar reacciones de hipersensibilidad
durante el tratamiento. Los síntomas y signos incluyen disnea aguda con
respiración sibilante; apnea aguda; prurito; eritema; trastornos del estado
de ánimo; sudor anormal; urticaria; enrojecimiento cutáneo generalizado
o localizado; edema de la cara, manos o pies; hipertensión; hipotensión;
tasas de pulso elevadas; arritmia; hiperemia ocular; hipoestesia; fiebre;
leucopenia y trombocitopenia.
• Efectos secundarios tales como hipertensión, hipotensión, cefalea, dolor
torácico, dolor estomacal, fatiga y náuseas que pueden estar asociados
con hipovolemia o hipervolemia, pueden normalmente evitarse mediante
un manejo cuidadoso del volumen de líquidos del paciente y el equilibrio
electrolítico, así como la velocidad del flujo sanguíneo y la presión
transmembrana (PTM).
4. ADVERTENCIAS
Siga estas instrucciones y las del proveedor del equipo de HD. El uso
inadecuado puede causar lesiones o la muerte. El fabricante no se hace
responsable de la seguridad del paciente si no se siguen estas instrucciones
y las instrucciones del proveedor del equipo de HD. Asegúrese de que estas
instrucciones estén a disposición del operario en el lugar de tratamiento.
El REXEED-A está indicado para una única utilización. La
reelaboración de REXEED-A puede causar efectos adversos para el
paciente o fallo del producto.
El usuario debe utilizar el REXEED-A antes de la fecha de caducidad.
Hágase referencia a la etiqueta del producto REXEED-A para conocer la
fecha de caducidad.
El REXEED-A debe mantenerse en un entorno limpio, seco y lejos de
los rayos directos del sol, del calor y de la humedad y a una temperatura
de entre 0 y 30°C (32-86°F).
Cuando el fabricante envía el REXEED-A, éste contiene una solución de
llenado. No se debe permitir que este líquido se congele. Nunca se debe
utilizar un REXEED-A si el líquido se ha congelado, incluso después de
que el líquido se haya descongelado.
El REXEED-A es un producto de plástico y no debe ser expuesto a
vibraciones o impactos durante el transporte, almacenamiento o
manipulación.
Para evitar fisuras o deformaciones, el REXEED-A no debe ser expuesto
a solventes orgánicos como el alcohol.
Inspeccione cada REXEED-A antes de su utilización y reemplácelo si
muestra signos de desperfectos, desperfecto o cierre inadecuado de la
bolsa de esterilización, fuga de la solución líquida del REXEED-A a la
bolsa de esterilización, tapones no alineados o separados.
Asegúrese de que los compartimientos de dializado y de sangre del
REXEED-A sean enjuagados antes de su utilización según el
procedimiento de cebado descrito a seguir.
Cuide que el procedimiento de actuación durante el cebado y el
tratamiento sea en condiciones asépticas.
No extraer el líquido antes de enjuagar y llenar el compartimiento de la
sangre con la solución salina para así prevenir que entre aire en el
REXEED-A.
La solución salina debe ser una solución fisiológica estéril y apirógena.
Debido al alto coeficiente de ultrafiltración, sólo se debe utilizar el
REXEED-A con equipos de HD que cuenten con un controlador de UF
(Refiérase a las instrucciones del equipo de HD).
El dializado debe ser conforme a las normas locales o a las normas ISO
sobre calidad de agua para diálisis para minimizar el riesgo de efectos
adversos.
Se recomienda usar conectores (hembra) para los orificios de la sangre y
el dializado fijados a los tubos de sangre y dializado cuyo diseño cumpla
con las normas ISO 8637:2004 e ISO 8638:2004.
Asegúrese de que los sensores, los detectores y el sistema de alarma del
equipo de HD se hallan en las condiciones de funcionamiento adecuadas,
incluidos el sensor de aire venoso y el detector de fugas de sangre de
acuerdo con las instrucciones del equipo de HD antes del inicio del
tratamiento.
Asegúrese de durante la operación de cebado sea extraído todo el aire
del REXEED-A y de los tubos de la sangre; si no se extrae todo el aire,
se puede producir una coagulación sanguínea durante el tratamiento.
Además, asegúrese también de que no entre aire en los vasos sanguíneos
del paciente durante el retorno de la sangre.
Durante el cebado y el tratamiento, verifique que no hay fugas desde el
dializador, los tubos de sangre, los orificios de la sangre y sus piezas de
conexión. Si hay fugas, reemplace el dializador o los tubos de sangre.
Si el dializado ha de ser utilizado en lugar de la solución salina o el
líquido de sustitución, se tienen que tomar precauciones para asegurar
que la pureza del dializado esté de acuerdo con las normas aplicables
sobre calidad del agua (por ejemplo, dializado para infusión definido en
la norma ISO 11663:2009).
En caso de que haya un problema durante el tratamiento, tal como fuga
de sangre o coagulación, interrumpir inmediatamente el tratamiento
siguiendo las instrucciones del médico y reemplazar el REXEED-A con
un dializador nuevo cebado.
REXEED-A tiene múltiples puntos de conexión. No realizar las
conexiones correctamente puede comprometer el tratamiento, causar
lesiones o la muerte a causa de fugas de sangre o de los fluidos de
terapia.
REXEED-A puede extraer medicamentos administrados en el tubo de
sangre arterial. Administre medicamentos post-dializador a menos que
se indique lo contrario.
Evite que la PTM exceda los 500 mmHg (66 kPa), estando la PTM
definida según la norma ISO 8637:2004.
Se debe tener en cuenta los rangos recomendados para los parámetros de
tratamiento especificados en el APÉNDICE al planificar el tratamiento
para los pacientes.
Deseche el REXEED-A y los tubos de sangre utilizados siguiendo
minuciosamente las normas oficiales e institucionales sobre la
eliminación de desechos médicos.
5. ESPECIFICACIONES Y FUNCIONAMIENTO
Membrana, REXBRANETM (Polisulfona / PVP); Recipiente y cabezales,
Bloque de copolímero de estireno-butadieno; Tapones, Polietileno y bloque
de copolímero de estireno-butadieno hidrogenado; Encapsulantes,
Poliuretano
Esterilizado por rayos gamma
La vía de sangre es apirógena.
Consúltese el APÉNDICE para ver las especificaciones del diseño y los
datos de las pruebas in vitro de los distintos modelos de REXEED-A. En un
entorno clínico, el funcionamiento del REXEED-A puede diferir del de las
pruebas in vitro; este funcionamiento puede variar en función de las
condiciones y la duración del tratamiento.
6. ANTICOAGULACIÓN
La necesidad de administrar anticoagulantes dependerá de la situación del
paciente. El tipo, cantidad y método de administración del anticoagulante
estarán determinados por el facultativo que conozca el cuadro clínico del
paciente.
7. USO
1. CEBADO
El orden de los procedimientos 2) y 3) puede ser invertido.
1) Colocar verticalmente el REXEED-A en el soporte, con el cabezal rojo
(extremo arterial) hacia abajo.
2) Conecte el tubo arterial de sangre con la bolsa de solución salina para la
infusión y llene totalmente el tubo de sangre arterial con la solución
salina. Conecte los tubos de sangre arterial y venosa con los orificios de
entrada y salida de la sangre. Tenga cuidado de no introducir aire en las
fibras huecas o en los tubos de sangre. A continuación, se lavan las
fibras huecas y los tubos de sangre con al menos 1000 mL de solución
salina, a aprox. 100 mL/min. Si hay aire atrapado en el dializador o los
tubos de sangre, introduzca más solución salina para el lavado y al
mismo tiempo dé ligeros golpecitos en el dializador con las manos o
pellizque y suelte los tubos de sangre, hasta que se elimine
completamente el aire. No intente eliminar el aire golpeando el
dializador con utensilios duros, por ejemplo fórceps, porque se puede
dañar el dializador.
3) Conecte las líneas de dializado a los orificios del dializado. Deje que el
dializado fluya durante 2 minutos o más a aprox. 500 mL/min. Para la
HDF, conectar el tubo de sustitución al orificio de sustitución y cebar el
tubo.
• Previa solicitud, le podemos suministrar un procedimiento de cebado
diferente para la HF.
• En lugar de solución salina, puede utilizarse dializado para infusión para
el cebado y la finalización del tratamiento.
2. INICIO DEL TRATAMIENTO
1) Conecte el tubo de sangre arterial con la cánula arterial del paciente.
Inicie el funcionamiento de la bomba de sangre para desplazar la
solución salina (a aprox. 100 mL/min).
2) Conecte el tubo de sangre venosa a la cánula venosa.
• Para la HDF, el nivel de flujo de ultrafiltración se debe supervisar con
cuidado bajo la dirección de un facultativo que conozca el cuadro clínico
del paciente. Para algunos pacientes, por ejemplo, los que tienen un valor
de hematocrito alto, un nivel de flujo de ultrafiltración alto puede
provocar el aumento de la presión de entrada de la sangre.
3. FINALIZACIÓN DEL TRATAMIENTO
1) Ajuste el nivel de flujo de UF y detenga la bomba de sangre.
2) Retire la cánula arterial del paciente y conecte el tubo de sangre arterial
a la bolsa de solución salina. Introduzca entre 100 y 200 mL de solución
salina, en las fibras huecas y las líneas de sangre, volviendo a poner en
marcha la bomba de sangre lentamente, para que ésta retorne depurada
al paciente.
3) Pince el tubo de sangre venosa y retire la cánula venosa del paciente.
8. GARANTÍA Y RESPONSABILIDAD LIMITADA
• El fabricante garantiza que REXEED-A es fabricado de conformidad con
sus especificaciones y según la norma ISO 9001:2008, ISO 13485:2003,
las normas industriales aplicables y los requisitos normativos.
• Si se le notifican al representante del fabricante defectos de fabricación o
daños ocurridos durante el transporte, el fabricante sustituirá el
REXEED-A por uno nuevo, por medio de su representante.
• El fabricante no se hace responsable de ningún daño causado por la
reutilización del REXEED-A, ni por su uso inapropiado, manipulación
inadecuada, incumplimiento de las advertencias e instrucciones, daños
ocurridos con posterioridad a la entrega del producto, falta de
comprobación del buen estado del producto previo a su uso o cualquier
garantía que haya sido concedida por distribuidores independientes.

6
PORTUGUÊS
HEMODIALISADOR INSTRUÇÕES DE UTILIZAÇÃO
DIALISADOR ASAHI DA SÉRIE REXEEDTM-A
1. INDICAÇÕES DE USO
O dialisador da série Asahi REXEEDTM-A (doravante designado
REXEED-A) está indicado para o uso em hemodiálise (HD),
hemodiafiltração (HDF) e hemofiltração (HF) para o tratamento de
pacientes que sofrem de insuficiência renal aguda ou crónica.
2. CONTRA-INDICAÇÕES
Nenhuma conhecida. Em geral, aplicam-se as contra-indicações para a HD,
HDF e HF.
3. REACÇÕES ADVERSAS
• Consulte imediatamente um médico responsável sempre que ocorrer uma
reacção adversa.
• Alguns pacientes poderão desenvolver reacções de hipersensibilidade
durante o tratamento. Os sinais e sintomas incluem dispneia aguda com
pieira; paragem respiratória; prurido; rubor; mal-estar; sudação anormal;
urticária; vermelhidão cutânea generalizada ou localizada; edema na face,
mãos ou pés; hipertensão; hipotensão; pulsação elevada; arritmia;
hiperemia ocular; hipoestesia; febre; leucopenia e trombocitopenia.
• Efeitos secundários como, por exemplo, hipertensão, hipotensão,
cefaleia, dor no peito, dor de estômago, fadiga e náuseas que podem estar
associados a hipovolemia ou hipervolemia, podem normalmente ser
evitados através da supervisão cuidadosa de volume do líquido do
paciente e equilíbrio do electrólito, bem como a taxa de fluxo sanguíneo
e pressão transmembranária (PTM).
4. AVISOS
Deve seguir estas instruções e as do fornecedor da máquina de HD. A
utilização incorrecta pode causar lesões ou morte. O fabricante não será
responsável pela segurança do paciente caso estas instruções e as do
fornecedor da máquina de HD não sejam seguidas. Confirme que estas
instruções estão acessíveis ao operador no local de tratamento.
O REXEED-A está indicado apenas para utilização única. O
reprocessamento do REXEED-A pode provocar reacções adversas no
paciente e/ou falha no dispositivo.
O utilizador tem de usar o REXEED-A antes do final da data de
validade. Consulte o rótulo do produto REXEED-A para obter a data de
validade.
O REXEED-A tem de ser conservado em ambiente limpo e seco,
resguardado da luz solar directa, calor e humidade e a temperaturas
entre 0-30°C (32-86°F).
O REXEED-A, quando expedido pelo fabricante, está cheio com
líquido. Este líquido não deve ser submetido a congelação. O
REXEED-A com líquido congelado nunca deve ser usado, mesmo após
a descongelação do líquido.
O REXEED-A é um produto plástico e não deve ser exposto a vibração
ou impacto durante o transporte, armazenamento ou manuseamento.
O REXEED-A não deve ser exposto a solventes orgânicos tal como
álcool de modo a evitar rachaduras ou deformações.
Inspeccione cada REXEED-A antes da utilização, e substitua-o se este
apresentar indícios de danos, danos ou selagem imprópria do saco de
esterilização, fuga de líquido do REXEED-A para o saco de
esterilização, rolhas desalinhadas ou separadas.
Certifique-se de que os compartimentos do dialisado e do sangue do
REXEED-A são lavados antes da utilização de acordo com o
procedimento de preparação descrito a seguir.
Use a técnica asséptica durante a preparação e tratamento.
Não remova o líquido antes de enxaguar e encher o compartimento de
sangue com solução salina, de modo a impedir a entrada de ar no
REXEED-A.
A solução salina deverá ser uma solução fisiológica estéril e não
pirogénica.
Devido ao seu elevado coeficiente de ultrafiltração, o REXEED-A só
pode ser usado com máquinas de HD equipadas com um controlador UF
(Consulte as instruções da máquina de HD).
O dialisado tem de respeitar os padrões regionais ou as normas ISO de
qualidade da água para diálise, para minimizar o risco de reacções
adversas.
É recomendado o uso de conectores (fêmea) do orifício de sangue e de
dialisado ligados às linhas de sangue e de dialisado, conformes com as
normas ISO 8637:2004 e ISO 8638:2004.
Certifique-se de que os sensores, detectores e sistema de alarme da
máquina de HD estão em condições apropriadas de funcionamento,
incluindo o sensor de ar contaminado e o detector de vazamento de
sangue de acordo com as instruções da máquina de HD antes de iniciar o
tratamento.
Certifique-se de que o ar é completamente purgado do REXEED-A e
linhas de sangue durante a preparação; caso o ar não seja purgado
correctamente poderá resultar na formação de coágulos durante o
tratamento. Para além disso, certifique-se de que não entra ar no vaso
sanguíneo do paciente durante o regresso do sangue.
Durante a preparação e o tratamento, verificar se há fugas do dialisador,
das linhas de sangue, dos orifícios de sangue ou das respectivas peças de
conexão. Em caso de fugas, substituir o dialisador ou as linhas de
sangue.
Se se utilizar dialisado em vez de solução salina ou de líquido de
substituição, têm de ser tomadas medidas de modo a garantir a sua
pureza de dialisado, de acordo com os padrões de qualidade da água
aplicáveis (por exemplo, o dialisado para infusão, definido na norma
ISO 11663:2009).
Na eventualidade de um problema durante o tratamento, tal como
vazamento de sangue ou coagulação, interrompa imediatamente o
tratamento seguindo as indicações de um médico e substitua o
REXEED-A por um dialisador novo já preparado.
O REXEED-A possui múltiplos pontos de conexão. Uma conexão
incorrecta pode causar tratamento comprometido, lesão ou morte devido
a fuga de sangue ou líquido terapêutico.
O REXEED-A pode remover a medicação dada na linha de sangue
arterial. Se não houver outras instruções, administre a medicação após
dialisador.
Não permita que a PTM exceda 500 mmHg (66 kPa), sendo a PTM
definida de acordo com a norma ISO 8637:2004.
Os intervalos recomendáveis dos parâmetros de tratamento
especificados no APÊNDICE devem ser tomados em consideração,
quando se faz a programação do tratamento dos pacientes.
Elimine o REXEED-A e as linhas de sangue usados estritamente de
acordo com as práticas de eliminação de resíduos médicos oficiais e
institucionais.
5. ESPECIFICAÇÕES E DESEMPENHO
Membrana, REXBRANETM (Polissulfone / PVP); Encaixe e cabeças,
Copolímero de blocos de estireno-butadieno; Rolhas, Polietileno e
copolímero de blocos de estireno-butadieno hidrogenado; Material de
fixação, Poliuretano
Esterilizado por raios gama
O percurso do sangue é não pirogénico.
Consulte o APÊNDICE para especificações de desenho e informação de
desempenho in vitro relativas a modelos REXEED-A individuais.
Clinicamente, o desempenho do REXEED-A pode divergir do in vitro,
podendo variar conforme as condições e a duração do tratamento.
6. ANTICOAGULAÇÃO
Os requisitos de anticoagulante irão variar de acordo com o estado do
paciente; o tipo, quantidade e método de administração de anticoagulante
deve estar de acordo com as indicações de um médico que esteja
familiarizado com o estado do paciente.
7. FUNCIONAMENTO
1. PREPARAÇÃO
A ordem dos procedimentos 2) e 3) pode ser invertida.
1) Coloque o REXEED-A em posição vertical no suporte, com a cabeça
vermelha (extremidade arterial) virada para baixo.
2) Ligue a linha de sangue arterial ao saco de solução salina para infusão e
encha a linha de sangue arterial por completo com solução salina. Ligue
as linhas de sangue arterial e venoso aos orifícios de entrada e saída de
sangue. Tenha cuidado para não inserir ar nas fibras ocas e linhas de
sangue. Enxagúe as fibras ocas e linhas de sangue com pelo menos 1000
mL de solução salina a aprox. 100 mL/min. Se houver ar retido no
dialisador ou nas linhas de sangue, introduza mais solução salina para
lavagem, dando simultaneamente ligeiras pancadas com a mão no
dialisador ou apertando e soltando com os dedos as linhas de sangue, até
remoção total desse ar. Não tente remover o ar com pancadas no
dialisador com instrumentos duros, tal como pinças, pois isso pode
danificar o dialisador.
3) Ligue as linhas de dialisado aos orifícios de dialisado. Deixe o dialisado
correr a aprox. 500 mL/min durante 2 minutos ou mais. Para HDF, ligue
a linha de substituição ao orifício de substituição e prepare a linha.
• Pode ser obtido um procedimento de preparação diferente para HF
mediante pedido.
• Em vez de solução salina, pode utilizar-se dialisado para infusão para a
preparação e término do tratamento.
2. INICIAR TRATAMENTO
1) Ligue a linha de sangue arterial à cânula arterial do paciente. Inicie a
bomba de sangue (aprox. 100 mL/min) para deslocar a solução salina.
2) Ligue a linha de sangue venoso à cânula venosa.
• Para HDF, a taxa de fluxo de ultrafiltração deve ser cuidadosamente
monitorizada sob a indicação de um médico que esteja familiarizado com
o estado do paciente. Em alguns pacientes, como por exemplo, pacientes
com o valor de hematócrito alto, a ultrafiltração com taxa de fluxo
elevada pode provocar aumento de pressão de entrada do sangue.
3. TERMINAR TRATAMENTO
1) Ajuste a taxa de fluxo de UF e pare a bomba de sangue.
2) Remova a cânula arterial do paciente e ligue a linha de sangue arterial
ao saco de solução salina. Forneça 100-200 mL de solução salina às
fibras ocas e linhas de sangue ao iniciar a bomba de sangue lentamente
para voltar a lavar o sangue do paciente.
3) Aperte a linha de sangue venoso com um grampo e remova a cânula
venosa do paciente.
8. GARANTIA E LIMITAÇÃO DE RESPONSABILIDADE
• O fabricante garante que o REXEED-A é fabricado de acordo com as
suas especificações e em conformidade com ISO 9001:2008, ISO
13485:2003, padrões de indústria aplicáveis e requisitos normativos.
• Se forem comunicados ao representante do fabricante quaisquer defeitos
provocados durante o fabrico ou transporte, o fabricante substituirá o
REXEED-A por um novo através do representante.
• O fabricante não será responsável por qualquer dano provocado pela
reutilização do REXEED-A, pelo uso incorrecto, manuseamento
impróprio, não cumprimento dos avisos e instruções, danos provocados
por acontecimentos posteriores ao lançamento do produto, falta de
garantia de condições adequadas antes da utilização ou qualquer garantia
dada por distribuidores independentes.

7
NEDERLANDS
HEMODIALYSATOR INSTRUCTIES
ASAHI REXEEDTM-A REEKS DIALYSATOR
1. GEBRUIKSTOEPASSING
De dialysator van de Asahi REXEEDTM-A reeks (hierna REXEED-A
genoemd) wordt gebruikt bij hemodialyse (HD), hemodiafiltratie (HDF) en
hemofiltratie (HF) voor de behandeling van patiënten met acute of
chronische nierinsufficiëntie.
2. CONTRA-INDICATIES
Geen bekend. Over het algemeen zijn de contra-indicaties voor HD, HDF
en HF van toepassing.
3. ONGEWENSTE EFFECTEN
• Raadpleeg onmiddellijk een goede arts wanneer een ongewenst effect
optreedt.
• Bij sommige patiënten kunnen overgevoeligheidsreacties optreden
tijdens de behandeling. Symptomen en tekenen zijn o.m. acute
kortademigheid met piepende ademhaling; ademstilstand; jeuk;
overmatig blozen; stemmingswisselingen; overmatig transpireren;
urticaria; algemene of plaatselijke roodheid van de huid; oedeem van
gezicht, handen of voeten; hypertensie; hypotensie; versnelde polsslag;
aritmie, oculaire hyperemie, hypo-esthesie, koorts, leukopenie en
thrombocytopenie.
• Bijwerkingen zoals hypertensie, hypotensie, hoofdpijn, pijn op de borst,
buikpijn, vermoeidheid en misselijkheid waarmee hypovolemie of
hypervolemie gepaard kan gaan, kunnen meestal worden vermeden door
een zorgvuldige beheersing van het vochtvolume en het
elektrolytenevenwicht, alsook de bloedstroomsnelheid en de
transmembraandruk (TMD) van de patiënt.
4. WAARSCHUWINGEN
Volg deze instructies en deze van de leverancier van het HD-toestel op.
Incorrect gebruik kan leiden tot verwondingen of dood. De fabrikant is niet
verantwoordelijk voor de veiligheid van de patiënt in het geval deze
instructies niet worden opgevolgd. Zorg ervoor dat deze instructies
beschikbaar zijn voor de operator op de plaats van behandeling.
De REXEED-A is bestemd voor eenmalig gebruik. Hergebruik van de
REXEED-A kan leiden tot ongewenste effecten voor de patiënt en/of
storing aan het product.
Gebruik de REXEED-A vóór de vervaldatum. Raadpleeg het etiket van
de REXEED-A om de vervaldatum te kennen.
Bewaar de REXEED-A in een schone, droge omgeving, niet
blootgesteld aan rechtstreeks zonlicht, warmte, en vochtigheid, en bij
temperaturen tussen 0-30°C (32-86°F).
Bij verzending door de fabrikant is de REXEED-A gevuld met vloeistof.
Laat deze vloeistof nooit bevriezen. Gebruik de REXEED-A nooit met
bevroren vloeistof, zelfs niet nadat de vloeistof ontdooid is.
De REXEED-A is een kunststof product en mag niet blootgesteld
worden aan trillingen of schokken tijdens transport, opslag of hantering.
De REXEED-A dient niet blootgesteld te worden aan organische
oplosmiddelen zoals alcohol om kraken of ontbinding te voorkomen.
Controleer elke REXEED-A zorgvuldig vóór gebruik en vervang hem
indien hij tekenen vertoont van schade, beschadiging of incorrecte
verzegeling van de sterilisatiezak, lekken van vloeistof uit de
REXEED-A in de sterilisatiezak, of slecht geplaatste of losgeraakte
stoppen.
Spoel de dialysaat- en bloedcompartimenten van de REXEED-A goed
uit voor gebruik, zoals beschreven in onderstaande priming procedure.
Gebruik steeds een steriele techniek tijdens priming en behandeling.
Verwijder de vloeistof niet voor u het bloedcompartiment met een
zoutoplossing hebt gespoeld en gevuld om te vermijden dat er lucht in
de REXEED-A komt.
De zoutoplossing moet een fysiologische oplossing zijn die steriel en
niet-pyrogeen is.
Door zijn hoge ultrafiltratiecoëfficiënt mag de REXEED-A alleen
worden gebruikt met HD-toestellen die zijn uitgerust met een
UF-regelaar (raadpleeg de instructies van het HD-toestel).
Het dialysaat moet beantwoorden aan de plaatselijke of ISO
-waterkwaliteitsnormen voor dialyse om het risico op ongewenste
effecten tot een minimum te beperken.
Het wordt aangeraden bloed- en dialysaatpoortconnectors (vrouwelijk)
aangesloten op bloed- en dialysaatlijnen die voldoen aan ISO 8637:2004
en ISO 8638:2004 te gebruiken.
Zorg dat de sensors, detectors en het alarmsysteem van het HD-toestel
in de correcte gebruikstoestand zijn, inclusief de veneuze luchtsensor en
de bloedlekdetector in overeenkomst met de instructies van het
HD-toestel, voor u met de behandeling begint.
Zorg dat alle lucht volledig tijdens de priming uit de REXEED-A en de
bloedlijnen is verwijderd; indien er lucht achterblijft, kan dit tijdens de
behandeling bloedstolling veroorzaken. Zorg er verder ook voor dat er
bij het terugstromen van het bloed geen lucht in de bloedvaten van de
patiënt kann komen.
Controleer tijdens priming en behandeling of er geen lekkage is uit het
dialysator, de bloedlijnen, de bloedinlaat en –uitlaat en de verbindingen.
Als er lekkage is, vervang dan de dialysator of de bloedlijnen.
Indien dialysaat wordt gebruikt in plaats van een zoutoplossing of
substitutievloeistof, zorg er dan voor dat dit zuiver is conform de
toepasselijke waterkwaliteitsnormen (bijvoorbeeld dialysaat voor infusie,
gedefinieerd in ISO 11663:2009).
Indien zich een probleem voordoet tijdens de behandeling, zoals lekken
of stollen van bloed, zet de behandeling dan onder supervisie van een
arts onmiddellijk stop en vervang de REXEED-A door een nieuw
geprimede dialysator.
De REXEED-A heeft meerdere verbindingspunten. Een foute
verbinding kan resulteren in het mislukken van de behandeling,
verwonding, of de dood door een bloed- of behandelingsvloeistoflek.
De REXEED-A kan medicatie, gegeven in de arteriële bloedlijn,
verwijderen. Geef medicatie na gebruik van de dialysator behalve indien
er andere instructies zijn.
De TMD mag niet hoger zijn dan 500 mmHg (66 kPa) waarbij TMD
gedefinieerd is als in ISO 8637:2004.
Houd bij het plannen van behandelingen voor patiënten rekening met de
aanbevolen bereiken van de behandelingsparameters die staan
aangegeven in de BIJLAGE.
Verwijder de gebruikte REXEED-A en de bloedlijnen conform de
officiële en institutionele normen voor de verwerking van medisch
afval.
5. SPECIFICATIES & EIGENSCHAPPEN
Membraan, REXBRANETM (Polysulfoon / PVP); Behuizing en koppen,
Styreen-butadieen blok copolymeer; Stoppen, Polyethyleen en
gehydrogeneerd styreen-butadieen blok copolymeer ; Ingietmateriaal,
Polyurethaan
Gesteriliseerd met gammastralen
Het bloedcircuit is niet-pyrogeen.
Raadpleeg de BIJLAGE voor ontwerpspecificaties en informatie over de in
vitro eigenschappen van individuele REXEED-A modellen. In een klinische
omgeving kunnen de prestaties van REXEED-A afwijken van de prestaties
in vitro; de prestaties kunnen verschillen afhankelijk van de
omstandigheden en de duur van de behandeling.
6. ANTICOAGULATIE
De behoeften aan antistollingsmiddelen zullen verschillen naar gelang de
toestand van de patiënt: het type, de hoeveelheid en de toedieningsmethode
van de anticoagulantia moeten in overeenstemming zijn met de
aanwijzingen van een arts die vertrouwd is met de toestand van de patiënt.
7. WERKING
1. PRIMING
De volgorde van procedures 2) en 3) kan worden omgekeerd.
1) Plaats de REXEED-A vertikaal in de houder, met de rode kop (arteriële
kant) naar beneden.
2) Verbind de arteriële bloedlijn met de zoutzak en vul de arteriële
bloedlijn volledig met zoutoplossing. Verbind de arteriële en de veneuze
bloedlijnen met de bloedinlaten en -uitlaten. Zorg er voor dat geen lucht
in de holle vezels en de bloedlijnen raakt. Spoel de holle vezels en de
bloedlijnen met minstens 1000 mL zoutoplossing aan ongeveer 100
mL/min. Als er lucht in de dialysator of de bloedlijnen zit, voeg dan
extra zoutoplossing toe om te spoelen terwijl u zachtjes met uw handen
op de dialysator klopt of de bloedlijnen dichtknijpt en weer loslaat,
totdat de lucht helemaal is verwijderd. Probeer de lucht niet te
verwijderen door met harde instrumenten, zoals een tang, op de
dialysator te kloppen, omdat de dialysator daardoor beschadigd kan
worden.
3) Verbind de dialysaatlijnen met de dialysaatpoorten. Laat het dialysaat
gedurende 2 of meer minuten stromen aan ongeveer 500 mL/min.
Verbind voor HDF de substitutielijn met de substitutiepoort en zorg
voor priming van de lijn.
• Een verschillende primingprocedure voor HF kan op verzoek worden
verkregen.
• In plaats van zoutoplossing kan dialysaat voor infusie worden gebruikt
voor priming en aan het einde van de behandeling.
2. STARTEN MET DE BEHANDELING
1) Verbind de arteriële bloedlijn met de arteriële canule van de patiënt.
Start de bloedpomp (ongeveer 100 mL/min) om de zoutoplossing te
vervangen.
2) Verbind de veneuze bloedlijn met de veneuze canule.
• Voor HDF moet de ultrafiltratie-stroomsnelheid nauwkeurig worden
bewaakt onder leiding van een arts die bekend is met de toestand van de
patiënt. Bij sommige patiënten, bijvoorbeeld met een hoge
hematocrietwaarde, kan een hoge UF-stroomsnelheid een stijging van de
bloedinlaatdruk veroorzaken.
3. BEEINDIGEN VAN DE BEHANDELING
1) Pas de UF-stroomsnelheid aan en zet de bloedpomp stop.
2) Verwijder de arteriële canule van de patiënt en verbind de arteriële
bloedlijn met de zoutzak. Laat 100-200 mL zoutoplossing in de holle
vezels en de bloedlijnen lopen door de bloedpomp te starten om het
bloed van de patiënt langzaam terug te laten stromen.
3) Klem de veneuze bloedlijn af en verwijder de veneuze canule van de
patiënt.
8. GARANTIE EN BEPERKTE AANSPRAKELIJKHEID
• De fabrikant garandeert dat de REXEED-A geproduceerd is conform de
specificaties ervan en in overeenstemming met ISO 9001:2008, ISO
13485:2003, de toepasselijke industrienormen, en de wettelijke vereisten.
• Indien defecten veroorzaakt tijdens de fabricatie of het transport worden
gemeld aan een vertegenwoordiger van de fabrikant, zal de fabrikant via
de vertegenwoordiger de REXEED-A vervangen door een nieuw
exemplaar.
• De fabrikant kan niet aansprakelijk worden gesteld voor schade
veroorzaakt door het hergebruik van de REXEED-A, misbruik, onjuist
gebruik, niet-naleving van de waarschuwingen en aanwijzingen, schade
veroorzaakt door gebeurtenissen die plaatsvonden nadat het product werd
vrijgegeven, indien nagelaten wordt te controleren of het product in
goede toestand is voor gebruik, of enige garantie gegeven door
onafhankelijke Dealers.

8
SVENSKA
HEMODIALYSATOR BRUKSANVISNING
DIALYSATOR ASAHI REXEEDTM-A-SERIEN
1. ANVÄNDNINGSANVISNING
Asahi REXEEDTM-A-seriens dialysator (härefter kallad REXEED-A)
är avsedd att användas vid hemodialys (HD), hemodiafiltrering (HDF)
och hemofiltrering (HF) för behandling av patienter som lider av akut
eller kronisk njursvikt.
2. KONTRAINDIKATIONER
Inga kända. Generellt kan kontraindikationer för HD, HDF och HF
tillämpas.
3. OGYNNSAMMA REAKTIONER
• Kontakta ansvarig läkare omedelbart om en ogynnsam reaktion
uppkommer.
• Vissa patienter kan uppleva överkänslighetsreaktioner under
behandlingen. Symptom och tecken inkluderar akut andnöd med
pipande ljud, andningskramp, klåda, rodnad, nedstämdhet, onormal
svettning, hudutslag, allmän eller lokal hudrodnad, ödem i ansikte,
på händer eller fötter, högt blodtryck, lågt blodtryck, förhöjd puls,
arytmi, okulär hyperemi, hypoestesi, feber, leukopeni och
trombocytopeni.
• Biverkningar som högt blodtryck, lågt blodtryck, huvudvärk,
bröstsmärtor, magont, trötthet och illamående som kan kopplas till
hypovolemi eller hypervolemi kan oftast undvikas genom noggrann
övervakning av patientens vätskevolym samt elektrolytbalansen,
blodcirkulationen och transmembrantrycket (TMP).
4. VARNINGAR
Följ dessa bruksanvisningar och de från HD-maskinens försäljare.
Vårdslöst användande kan orsaka skada eller död. Tillverkaren kommer
inte att ansvara för patientens säkerhet om dessa bruksanvisningar och
bruksanvisningar från HD-maskinens försäljare inte följs. Se till att
dessa bruksanvisningar är tillgängliga för användaren på platsen för
användning.
REXEED-A är endast avsedd för engångsbruk. Ombearbetning av
REXEED-A kan leda till ogynnsamma reaktioner hos patienten
och/eller apparatfel.
Användaren måste använda REXEED-A före utgångsdatum. Läs på
produktetiketten för REXEED-A där utgångsdatum finns angivet.
REXEED-A måste förvaras i en ren, torr miljö skyddad från direkt
solljus, värme, fukt och vid en temperatur mellan 0-30°C (32-86°F).
REXEED-A är fylld med vätska när den skickas från tillverkaren.
Denna vätska får inte tillåtas att frysa. REXEED-A med frusen
vätska får aldrig användas, inte ens efter att vätskan tinats.
REXEED-A är en plastprodukt och får inte utsättas för vibration
eller stötar under transport, förvaring eller hantering.
REXEED-A får inte utsättas för organiska lösningar, såsom alkohol,
för att förebygga sprickbildning eller deformering.
Inspektera varje REXEED-A före användning och byt den vid
tecken på skada, vid skada eller otillräcklig försegling av
steriliseringspåsen, vid läckande vätska från REXEED-A in i
steriliseringspåsen, samt vid felriktade eller separerade stopp.
Kontrollera att dialysat- och blodbehållaren i din REXEED-A är
sköljda före användning, i enlighet med rengöringsbeskrivningen
nedan.
Använd aseptisk teknik vid all rengöring och behandling.
Töm inte ur vätskan förrän blodbehållaren rengörs och fylls med
koksaltlösning, så att inte luft kommer in i din REXEED-A.
Koksaltlösningen måste vara en fysiologisk lösning som är steril
och icke-pyrogen.
På grund av sin höga ultrafiltreringskoefficient får REXEED-A
enbart användas tillsammans med HD maskiner som är utrustade
med UF-kontroll (läs HD-maskinens bruksanvisning).
Dialysat måste uppfylla de regionala eller ISO kvalitetsstandarderna
för vatten till dialys, för att minska risken för ogynnsamma
reaktioner.
Se till att blod- och dialysatportkontakterna (honor) som ansluts till
blod- och dialysatslangarna uppfyller ISO 8637:2004 och ISO
8638:2004.
Se till att sensorer, detektorer och alarmsystem för HD maskinen är
i fungerande tillstånd inklusive den venösa luftsensorn och
blodläckagesensorn enligt bruksanvisningarna för HD maskinen
innan behandlingen startas.
Se till att din REXEED-A och blodslangarna avluftas helt vid
rengöringen. Om detta inte görs kan blodet koagulera under
pågående behandling. Se dessutom till att det inte kommer in någon
luft i patientens blodkärl när blodet returneras.
Vid rengöring och behandling, kontrollera alltid att dialysatorn,
blodslangar, blodportar och tillhörande anslutningsdelar är fria från
läckage. Om läckage upptäcks, måste dialysatorn eller
blodslangarna bytas ut.
Om dialysat ska användas istället för koksaltlösning eller
ersättningslösning måste man vara noga med dess renhet i enlighet
med tillämplig standard för vattenkvalitet (till exempel dialysat för
infusion enligt definitionen i ISO 11663:2009).
Om ett problem som t ex blodläckage eller koagulering uppstår
under pågående behandling, ska behandlingen omedelbart avbrytas
enligt läkares anvisning och REXEED-A ska ersättas med en ny,
rengjord dialysator.
REXEED-A har flera anslutningspunkter. Om inte rätt anslutningar
görs kan det leda till att behandlingen äventyras, skada eller död på
grund av blod- eller terapivätskeläckage.
REXEED-A kan ta bort medicinering som givits i den artiella
blodslangen. Medicinera i den artiella blodslangen efter dialysatorn
om inte annat anvisas.
Låt inte TMP-trycket överskrida 500 mmHg (66 kPa) enligt
definitionen av TMP i ISO 8637:2004.
Vid planering av patientbehandling bör hänsyn tas till
behandlingsparametrarnas rekommenderade intervall, som anges i
BILAGAN.
Kasta den använda REXEED-A-enheten och blodslangarna i
absolut enlighet med officiella och institutionella standarder för
avyttring av medicinskt avfall.
5. TEKNISKA DATA OCH PRESTANDA
Membran, REXBRANETM (polysulfon / PVP); Hölje och huvuden,
styren-butadien-block-sampolymer; Stopp, polyetulen och hydrerad
styren-butadien-block-sampolymer; Ingjutningsmaterial, polyuretan.
Steriliserat med gammastrålning
Blodbanan är icke-pyrogen.
Referera till BILAGAN för konstruktionsdata och information om
prestanda in vitro för individuella REXEED-A-modeller. Vid klinisk
tillämpning kan REXEED-A prestanda skilja sig från data som erhållits
in vitro; prestanda kan variera beroende på behandlingens varaktighet
och villkor.
6. ANTIKOAGULERING
Kraven på antikoagulant varierar beroende på patientens tillstånd.
Vilken typ, kvantitet och metod som ska användas för administrering
av antikoagulanten bestäms enligt instruktioner från en läkare som
känner till patientens tillstånd.
7. FUNKTION
1. RENGÖRING
Punkterna 2) och 3) kan utföras i omvänd ordning.
1) Placera REXEED-A vertikalt i hållaren med det röda huvudet
(arteriell ände) nedåt.
2) Anslut den arteriella blodslangen till påsen med koksaltlösning för
infusion och fyll hela den arteriella blodslangen med koksaltlösning.
Anslut de arteriella och venösa blodslangarna till blodets in- och
utloppsportar. Var försiktigt så att det inte kommer in luft i ihåliga
fibrerna och blodslangarna. Skölj de ihåliga fibrerna och
blodslangarna med minst 1000 mL koksalt vid ungefär 100 mL/min.
Om luft blir kvar inuti dialysatorn eller blodslangarna måste extra
koksaltlösning sättas in för att spola systemet samtidigt som man
försiktigt knackar på dialysatorn med händerna eller trycker och
släpper blodslangarna tills all luft kommit ut. Försök inte få ut
luften genom att knacka på dialysatorn med hårda verktyg som t.ex.
klämdon då dessa kan skada dialysatorn.
3) Anslut dialysatslangarna till dialysatportarna. Låt dialysatet flöda
vid ungefär 500 mL/min under minst två minuter. För HDF ansluts
ersättningsslangen till ersättningsporten och slangen rengörs.
• Annan rengöringsrutin för HF kan fås på begäran.
• Dialysat för infusion kan användas för rengöring och avslut av
behandlingen istället för koksaltlösning.
2. START AV BEHANDLING
1) Anslut den arteriella blodslangen till patientens artärkanyl. Starta
blodpumpen (ungefär 100 mL/min) för att förskjuta
koksaltlösningen.
2) Anslut den venösa blodslangen till den venösa kanylen.
• För HDF, bör ultrafiltreringsflödet hållas under kontroll av en läkare
som väl känner till patientens tillstånd. Hos vissa patienter, exv
sådana som har höga hematokrit-värden, kan höga
ultrafiltreringsflödet hållas orsaka en ökning av blodets inloppstryck.
3. AVSLUTA BEHANDLING
1) Justera UF-flödet och stäng av blodpumpen.
2) Ta bort den arteriella kanylen från patienten och anslut den
arteriella blodslangen till påsen med koksaltlösning. Mata in
100-200 mL koksaltlösning i de ihåliga fibrerna och blodslangarna
genom att starta blodpumpen sakta, för att skölja tillbaka patientens
blod.
3) Kläm ihop den venösa blodslangen och ta bort den venösa kanylen
från patienten.
8. GARANTI OCH BEGRÄNSAD ANSVARSSKYLDIGHET
• Tillverkaren garanterar att REXEED-A är tillverkad i enlighet med
sina specifikationer och i överensstämmelse med ISO 9001:2008,
ISO 13485:2003, tillämpliga branschstandarder och förordningar.
• Om eventuella defekter som orsakats vid tillverkning eller under
transport meddelas tillverkarens representant, kommer tillverkaren
att ersätta din REXEED-A med en ny via representanten.
• Tillverkaren kommer inte att vara ansvarsskyldig för eventuell skada
orsakad av att din REXEED-A återanvänts, missbrukats, hanterats
felaktigt, av att varningar och bruksanvisningar inte följts, för skada
som orsakats av händelser som uppstått efter att produkten lanserats,
underlåtenhet att kontrollera produktens skick före användning eller
eventuell garanti som lämnats av fristående distributörer.

9
SLOVENČINA
HEMODIALYZÁTOR NÁVOD NA POUŽITIE
DIALYZÁTOR ASAHI SÉRIE REXEEDTM-A
1. INDIKÁCIE NA POUŽITIE
Dialyzátor Asahi série REXEEDTM-A (ďalej nazývaný len
REXEED-A) je určený na použitie pri hemodialýze
(HD), hemodiafiltrácii (HDF) a hemofiltrácii (HF) na liečbu
u pacientov s akútnym alebo chronickým renálnym zlyhaním.
2. KONTRAINDIKÁCIE
Nie sú žiadne známe. Vo všeobecnosti platia kontraindikácie uvádzané
pre HD, HDF a HF.
3. NEŽIADUCE REAKCIE
• Pri výskyte nežiaducich reakcií okamžite informujte zodpovedného
lekára.
• U niektorých pacientov sa počas liečby môžu vyskytnúťreakcie z
precitlivelosti. Symptómy a znaky zahrňujú akútnu dychovú
nedostatočnosťso stridorom, zástavu dychu, svrbenie, začervenanie,
poruchy nálady, nadmerné potenie, vyrážky, celkové alebo lokálne
začervenanie kože, opuch tváre, rúk alebo nôh, hypertenziu,
hypotenziu, zrýchlený pulz, arytmiu, očnú hyperémiu, hypestéziu,
horúčku, leukopéniu a trombocytopéniu.
• Vedľajším účinkom, ktoré môžu byťspojené s hypervolémiou alebo
hypovolémiou, ako je hypertenzia, hypotenzia, bolesťhlavy, bolesťv
hrudníku, bolesťžalúdka, únava a nauzea, je možné zabrániť
pozornou starostlivosťou o objem telesných tekutín a rovnováhu
elektrolytov pacienta, ako aj krvný prietok a transmembránový tlak
(TMT).
4. UPOZORNENIA
Dodržiavajte tento návod a návod pre HD prístroj poskytnutý
dodávateľom. Nesprávne použitie môže spôsobiťujmu na zdraví alebo
smrť. Výrobca nenesie zodpovednosťza pacientovu bezpečnosť, ak
tento návod a návod pre HD prístroj poskytnutý dodávateľom nie sú
dodržané. Uistite sa, že operátor na mieste liečby má tento návod k
dispozícii.
REXEED-A je určený len na jedno použitie. Regenerácia
REXEED-A môže spôsobiťnežiaduce reakcie u pacienta alebo
poruchu výrobku.
Užívateľmusí REXEED-A použiťpred dátumom expirácie. Dátum
expirácie REXEED-A nájdete na označení produktu.
REXEED-A sa musí skladovaťv čistom, suchom prostredí mimo
priameho slnka, tepla a vlhkosti a pri teplotách 0-30°C (32-86°F).
REXEED-A je dodávaný výrobcom naplnený tekutinou. Táto
tekutina nesmie zamrznúť. V prípade, že tekutina zamrzne, sa
REXEED-A nikdy nesmie použiť, dokonca ani po rozmrazení
tekutiny.
REXEED-A je plastový produkt a nesmie sa počas prepravy,
skladovania alebo zaobchádzania vystavovaťvibráciám alebo
nárazom.
REXEED-A sa nesmie vystavovaťvplyvu organických rozpúšťadiel
ako napr. alkoholu, aby sa zabránilo vzniku prasklín alebo
deformáciám.
Pred použitím skontrolujte každý REXEED-A a vymeňte ho, ak
ukazuje známky poškodenia, poškodeného alebo zlého tesnenia
sterilizačného vaku, presakovania tekutín z REXEED-A do
sterilizačného vaku alebo nesprávneho nastavenia alebo rozdelenia
zátok.
Zaistite, že sa dialyzát a krvné oddiely REXEED-A prepláchnu pred
použitím podľa plniaceho postupu popísaného nižšie.
Pri plnení a liečbe používajte aseptické postupy.
Aby nedošlo k prieniku vzduchu do REXEED-A, pred
prepláchnutím a plnením krvných oddielov roztokom neodstraňujte
tekutinu.
Roztok musí byťfyziologický roztok, ktorý je sterilný a
nepyrogénny.
Kvôli vysokému ultrafiltračnému koeficientu sa REXEED-A musí
používaťlen s HD prístrojmi s kontrolou UF (Pozri návod HD
prístroja).
Dialyzát musí spĺňaťregionálne normy kvality alebo normy kvality
ISO pre vodu určenú na dialýzu, aby sa minimalizovalo riziko
nežiaducich reakcií.
Odporúčame použiťkonektory (dutinkové) krvných a dialyzačných
otvorov pripojené ku krvným a dialyzačným líniám, ktoré sú
navrhnuté v súlade s normami ISO 8637:2004 a ISO 8638:2004.
Zaistite, že senzory, detektory a poplachový systém HD prístroja,
vrátane venózneho vzduchového senzora a detektora presakovania
krvi, sú pred začiatkom liečby v správnom prevádzkovom stave v
súlade s návodom HD prístroja.
Zaistite, že počas plnenia je všetok vzduch vypustený z REXEED-A
a krvných línií; prítomnosťvzduchu by mohla počas liečby spôsobiť
zrážanie krvi. Ďalej zaistite, že počas krvného návratu sa do ciev
pacienta nedostane žiaden vzduch.
Počas plnenia a liečby skontrolujte, či nedochádza k presakovaniu z
dialyzátora, krvných línií, krvných otvorov a ich spájajúcich častí.
Ak spozorujete presakovanie, vymeňte dialyzátor alebo krvné línie.
Pri použití dialyzátu namiesto fyziologického alebo substitučného
roztoku sa musí zabezpečiťjeho čistota a kvalita podľa platných
noriem kvality vody (napríklad infúzny dialyzát je definovaný v
norme ISO 11663:2009).
Pri výskyte problému počas liečby, ako presakovanie krvi alebo
koagulácia, okamžite prerušte podľa nariadenia lekára liečbu a
nahraďte REXEED-A novým naplneným dialyzátorom.
REXEED-A má viacero spojovacích bodov. Nesprávne pripojenie
môže ohroziťliečbu, spôsobiťujmu na zdraví alebo smrťkvôli
úniku krvi alebo tekutiny určenej na liečbu.
REXEED-A môže odstrániťlieky z arteriálnej krvnej línie. Lieky
podávajte po použití dialyzátora, pokiaľste nedostali iné inštrukcie.
Nedovoľte, aby bol transmembránový tlak viac ako 500 mmHg (66
kPa), v zmysle definície TMT podľa normy ISO 8637:2004.
Pri plánovaní liečby pacientov by sa mali zvážiťodporúčané
rozsahy parametrov liečby špecifikované v PRÍLOHE.
Použitý REXEED-A a krvné línie zlikvidujte presne podľa
oficiálnych štandardov na likvidáciu medicínskeho odpadu.
5. ŠPECIFIKÁCIE A VÝKON
Membrána: REXBRANETM (polysulfón / PVP); kryt a označenia,
butadién-styrénový blokový kopolymér; zátky, polyetylén a
hydrogénovaný butadién-styrénový blokový kopolymér; zalievací
materiál, polyuretán
Sterilizovaný gama žiarením
Krvná cesta je nepyrogénna.
Informácie o konštrukčných špecifikáciách a in vitro výkone
jednotlivých modelov REXEED-A nájdete v PRÍLOHE. Pri klinickom
nastavení sa môže výkon REXEED-A líšiťod výkonu pri in vitro
aplikácii; tento výkon sa môže líšiťv závislosti od podmienok a trvania
liečby.
6. ANTIKOAGULÁCIA
Antikoagulačné požiadavky sa menia podľa stavu pacienta; typ,
množstvo a voľba podaného antikoagulantu by mala byťv súlade s
nariadeniami lekára poznajúceho stav pacienta.
7. PRACOVNÝ POSTUP
1. PLNENIE
Poradie krokov 2) a 3) môže byťobrátené.
1) Umiestnite REXEED-A vertikálne do držiaka s červeným
označením (arteriálny koniec) nadol.
2) Pripojte arteriálnu krvnú líniu k vaku s fyziologickým roztokom pre
infúziu a naplňte arteriálnu krvnú líniu kompletne roztokom.
Pripojte arteriálne a venózne krvné línie ku otvoru krvného vstupu a
výstupu. Dávajte pozor, aby sa do dutých vlákien a krvných línií
nedostal vzduch. Prepláchnite duté vlákna a krvné línie najmenej
1000 ml roztoku rýchlosťou približne 100 ml/min. Ak sa
do dialyzačných alebo krvných línií dostane vzduch, zaveďte ďalší
roztok na prepláchnutie, pričom jednou rukou jemne poklepávajte
po dialyzátore alebo stláčajte a uvoľňujte krvné línie, kým sa
vzduch neodstráni úplne. Nesnažte sa vzduch odstrániť
poklepávaním po dialyzátore tvrdými nástrojmi, napr. kliešťami,
pretože môže dôjsťk poškodeniu dialyzátora.
3) Pripojte dialyzačné línie k dialyzačným otvorom. Nechajte dialyzát
tiecťrýchlosťou približne 500 ml/min na 2 min alebo dlhšie. Pri
HDF pripojte substitučnú líniu k substitučnému otvoru a naplňte ju.
• Pri HF sa používa iný postup plnenia, ktorý vám na požiadanie
poskytneme.
• Namiesto fyziologického roztoku sa môže na plnenie a na ukončenie
liečby použiťinfúzny dialyzát.
2. ZAČIATOK LIEČBY
1) Pripojte arteriálnu krvnú linku k arteriálnej kanyle pacienta. Zapnite
krvnú pumpu na preliatie roztoku (rýchlosťou približne 100
ml/min).
2) Pripojte venóznu krvnú líniu k venóznej kanyle.
• Čo sa týka HDF, prietoková rýchlosťultrafiltrácie by sa mala
dôkladne monitorovaťpod dozorom lekára, ktorý je oboznámený so
stavom pacienta. U niektorých pacientov, napr. ktorí majú vysoké
hodnoty hematokritu, môže vysoká prietoková rýchlosťultrafiltrácie
spôsobiťzvýšenie krvného tlaku na vstupe.
3. UKONČENIE LIEČBY
1) Upravte prietokovú rýchlosťUF a zastavte krvnú pumpu.
2) Vytiahnite arteriálnu kanylu z pacienta a pripojte arteriálnu krvnú
líniu ku vaku s fyziologickým roztokom. Naštartovaním krvnej
pumpy pomaly prepláchnite späťkrv pacienta, do dutých vlákien a
krvných línií dajte 100-200 ml roztoku.
3) Uzavrite venóznu krvnú líniu a vytiahnite z pacienta venóznu
kanylu.
8. ZÁRUKA A OBMEDZENÁ ZODPOVEDNOSŤ
• Výrobca sa zaručuje, že REXEED-A je vyrobený v súlade s jeho
špecifikáciami a priemyselnými štandardmi ISO 9001:2008, ISO
13485:2003, platnými priemyselnými štandardmi a regulačnými
požiadavkami.
• Ak sa zástupcovi výrobcu dajú na vedomie akékoľvek chyby
vzniknuté pri výrobe alebo preprave, výrobca nahradí REXEED-A
prostredníctvom svojho zástupcu novým výrobkom.
• Výrobca nenesie zodpovednosťza akúkoľvek škodu vzniknutú v
súvislosti s opakovaným použitím REXEED-A, nesprávnym
používaním a zaobchádzaním, nedodržiavaním upozornení a
pokynov, škodu spôsobenú udalosťami vzniknutými po dodaní
výrobku, pri neuistení sa, že výrobok je pred použitím v dobrom
stave alebo za záruku poskytnutú nezávislými dodávateľmi.

10
ČEŠTINA
HEMODIALYZÁTOR POKYNY PRO POUŽITÍ
DIALYZÁTOR ASAHI SÉRIE REXEEDTM-A
1. INDIKACE PRO POUŽITÍ
Dialyzátor Asahi série REXEEDTM-A (dále jen REXEED-A) je určen
pro použití při hemodialýze (HD), hemodiafiltraci (HDF) a hemofiltraci
(HF) pro léčbu pacientů, kteří trpí akutním nebo chronickým selháním
ledvin.
2. KONTRAINDIKACE
Nejsou známé. Obecněplatí kontraindikace pro HD, HDF a HF.
3. NEŽÁDOUCÍ ÚČINKY
• Pokud zjistíte výskyt nežádoucích účinků, ihned se obraťte na
odpovědného lékaře.
• V průběhu léčby se může u některých pacientůvyskytnout
přecitlivělost. Příznaky přecitlivělosti zahrnují akutní dušnost a
sípání, zástavu dýchání, svědění, zarudnutí, poruchy nálady,
abnormální pocení, vyrážku, generalizované nebo lokalizované
zarudnutí kůže, otoky obličeje, rukou a nohou, hypertenzi, hypotenzi,
zrychlený pulz, arytmii, oční hyperémii, hypestézii, horečku,
leukopenii a trombocytopenii.
• Vedlejším účinkům, jako je hypertenze, hypotenze, bolesti hlavy,
bolesti na hrudi, bolesti žaludku, únava a zvedání žaludku, které jsou
spojené s hypovolémií nebo hypervolémií, je obvykle možné
zabránit důkladnou péčí o množství tekutin pacienta a kontrolou
rovnováhy elektrolytu i rychlosti průtoku krve a kontrolou stavu
transmembránového tlaku (TMT).
4. UPOZORNĚNÍ
Dodržujte následující pokyny a instrukce dodavatele zařízení HD.
Nesprávné použití může způsobit zranění nebo smrt. Výrobce nenese
zodpovědnost za pacientovu bezpečnost v případě, že níže uvedené
pokyny či instrukce dodavatele zařízení HD nebyly dodrženy. Zajistěte,
aby byly následující pokyny k dispozici operátorovi na léčebném
pracovišti.
REXEED-A je určen pouze k jednomu použití. Obnova použitého
REXEED-A může vyvolat nežádoucí účinky u pacienta a/nebo
selhání prostředku.
Uživatel musí používat REXEED-A před uplynutím doby
použitelnosti. Viz štítek na produktu REXEED-A, kde je uvedena
doba použitelnosti.
REXEED-A musí být uchováván v čistém, suchém prostředí mimo
dosah slunečního záření, vysokých teplot a vlhkosti při teplotě
0-30°C (32-86°F).
REXEED-A je dodáván naplněný tekutinou výrobcem. Zabraňte
zamrznutí této tekutiny. Nikdy se nesmí používat REXEED-A se
zmrzlou tekutinou, dokonce ani po jejím rozmrznutí.
REXEED-A je plastový výrobek, který během přepravy, skladování
a manipulaci nesmí být vystaven otřesům nebo nárazům.
REXEED-A nesmí být vystaven organickým rozpouštědlům, jako je
např. alkohol, aby bylo zabráněno vzniku trhlin a deformací.
Před použitím každý REXEED-A zkontrolujte a při zjištění
jakéhokoliv poškození jej vyměňte; zkontrolujte, zda není
poškozený nebo nesprávněuzavřený sterilizační vak, zda nedošlo k
úniku tekutiny z REXEED-A do sterilizačního vaku a zda
uspořádání a oddělení uzávěrůnení chybné.
Ujistěte se, že jsou před použitím kompartmenty REXEED-A pro
dialyzát a krev vypláchnuty v souladu s postupy pro plnění
popsanými níže.
Při plnění a léčběpoužívejte aseptickou techniku.
Tekutinu před propláchnutím a plněním krevního kompartmentu
solným roztokem neodstraňujte, aby jste předešli vniknutí vzduchu
do REXEED-A.
Solný roztok musí být fyziologický roztok, který je sterilní a
apyrogenní.
Vzhledem k vysokému ultrafiltračnímu koeficientu, REXEED-A
musí být používán pouze se zařízeními HD vybavenými UF
ovladačem (viz pokyny pro zařízení HD).
Dialyzát musí vyhovět regionálním normám nebo normám ISO pro
kvalitu vody využívané v dialýze a minimalizovat tak riziko
nežádoucích účinků.
Doporučuje se používání (samičích) konektorůkrevních portůa
portůdialyzátu připojených ke krevním linkám a linkám dialyzátu,
které jsou vyrobeny v souladu s normami ISO 8637: 2004 a ISO
8638:2004.
Před zahájením léčby zkontrolujte, zda-li jsou snímače, detektory a
bezpečnostní systém zařízení HD, včetněsnímače vzduchu v žilách
a detektoru úniku krve, ve správném provozním stavu v souladu
s pokyny pro zařízení HD.
Zkontrolujte, zda byl při plnění z REXEED-A a krevních linek zcela
odstraněn vzduch. Neúplné odstranění vzduchu je příčinou vzniku
krevních sraženin během léčby. Následnězkontrolujte možnost
vniknutí vzduchu do krevní cévy pacienta při návratu krve.
Při plnění a léčbězkontrolujte, zda nedochází k úniku tekutin
z dialyzátoru, krevních linek, krevních portůa jejich spojovacích
dílů. Pokud zjistíte únik, vyměňte dialyzátor nebo krevní linky.
Pokud je místo solného roztoku nebo náhradní tekutiny použit
dialyzát, zajistěte, aby čistota dialyzátu odpovídala platným normám
kvality vody (například dialyzát pro infúze definovaný v norměISO
11663:2009).
Pokud během léčby dojde ke vzniku problémů, jako jsou únik krve
nebo koagulace, podle pokynůlékaře okamžitěléčbu přerušte a
REXEED-A vyměňte za nový naplněný dialyzátor.
REXEED-A je vybaven vícečetnými spojovacími díly. Nesprávný
způsob spojení může vest k neúplné léčbě, zranění či smrti vinou
úniku krve či terapeutických tekutin.
REXEED-A může odstranit léky aplikované do tepenné krevní linky.
Pokud není uvedeno jinak, aplikujte léky až za dialyzátorem.
Zabraňte, aby transmembránový tlak překročil 500 mmHg (66 kPa).
Transmembránový tlak je definován podle normy ISO 8637:2004.
Při plánování léčby pacientůje třeba zohlednit doporučené rozmezí
terapeutických parametrůuvedených v PŘÍLOZE.
Při likvidaci použitého REXEED-A a krevní linky, postupujte
striktněpodle platných právních a institucionálních standardůpro
likvidaci lékařského odpadu.
5. SPECIFIKACE A VÝKONNOSTNÍ CHARAKTERISTIKY
Membrána: REXBRANETM (polysulfon / PVP); Obal a hlavice:
butadien-styrenový blokový kopolymer; Uzávěry: polyetylénový a
hydrogenovaný butadien-styrenový blokový kopolymer; Zalévací
materiál: polyuretan.
Sterilizováno gama zářením
Cesta pro krev je apyrogenní.
Viz PŘÍLOHA pro specifikace designu a informace o výkonu in vitro
týkající se jednotlivých modelůREXEED-A. V klinickém prostředí
může být výkon REXEED-A odlišný od výkonu in vitro; tento výkon
se může lišit podle podmínek a délky léčby.
6. ANTIKOAGULACE
Požadavky na antikoagulant se liší dle stavu pacienta. Typ, množství a
metoda podání antikoagulantu musí být v souladu s pokyny lékaře,
který je obeznámený se stavem pacienta.
7. PROVOZ
1. PLNĚNÍ
Pořadí procedur 2) a 3) může být obrácené.
1) Umístěte REXEED-A vertikálnědo stojanu s červenou hlavicí
(tepenný konec) dolů.
2) Tepennou krevní linku připojte k vaku s solným roztokem pro infúzi
a zcela ji naplňte solným roztokem. Tepennou a žilní krevní linku
připojte k vstupnímu a výstupnímu otvoru pro krev. Dávejte pozor,
aby do dutých vláken a krevních linek nevnikl vzduch. Propláchněte
dutá vlákna a krevní linky minimálně1000 mL solného roztoku
rychlostí přibližně100 mL/min. Pokud v dialyzátoru nebo v
krevních linkách vznikne vzduchová bublina, propláchněte je dalším
solným roztokem, přičemž na dialyzátor jemněpoklepávejte rukou
nebo opakujte stisk a následné uvolnění krevních linek, dokud
vzduch zcela neodstraníte. Nepokoušejte se vzduch vypudit
poklepáváním tvrdými nástroji na dialyzátor, například nůžkami,
neboťby mohlo dojít k poškození dialyzátoru.
3) Připojte linku dialyzátu k portům dialyzátu. Ponechejte dialyzát
proudit rychlostí přibližně500 mL/min. po dobu 2 minut nebo více.
V případěHDF připojte náhradní linku k náhradnímu portu a
naplňte ji.
• Na požádání je možné získat různé plnicí postupy pro HF.
• Místo solného roztoku je pro plnění a ukončení léčby možné použít
dialyzát pro infúze.
2. ZAČÁTEK LÉČBY
1) Připojte linku tepenné krve k tepenné kanyle pacienta. Zapněte
krevní pumpu (rychlostí přibližně100 mL/min.) k odstranění
solného roztoku.
2) Připojte žilní krevní linku k žilní kanyle.
• U HDF je třeba průtok při ultrafiltraci bedlivěsledovat podle pokynů
lékaře, který je obeznámem se stavem pacienta. U některých
pacientů, např. u těch, jejichž hodnota hematokritu je vysoká, může
vysoký průtok při ultrafiltraci vyvolat zvýšení tlaku na vstupu pro
krev.
3. UKONČENÍ LÉČBY
1) Upravte průtokovou rychlost UF a zastavte krevní pumpu.
2) Vytáhněte tepennou kanylu z pacienta a připojte linku tepenné krve
k vaku s solným roztokem. Naplňte 100-200 mL solného roztoku do
dutých vláken a krevních linek spuštěním krevní pumpy pomalu pro
vymytí pacientovy krve.
3) Zasvorkujte linku žilní krve a vyjměte žilní kanylu z pacienta.
8. ZÁRUKA A OMEZENÁ ZODPOVĚDNOST
• Výrobce se zaručuje, že REXEED-A je vyroben dle svých
specifikací a v souladu s ISO 9001:2008, ISO 13485:2003, platných
průmyslových standardůa regulačních požadavků.
• Pokud jsou jakékoliv defekty způsobené během výroby či přepravy
oznámeny zástupci výrobce, provede výrobce výměnu REXEED-A
za nový kus prostřednictvím svého zástupce.
• Výrobce není zodpovědný za žádné poškození způsobené
opakovaným použitím REXEED-A, nesprávným použitím,
nesprávnou manipulací, nedodržením upozornění a pokynů,
poškození způsobená událostmi vyskytlými se po distribuci výrobku,
nezajištěním dobrého stavu výrobku před jeho použitím či za veškeré
záruky poskytnuté nezávislými distributory.

11
РУССКИЙ
ГЕМОДИАЛИЗАТОР ИНСТРУКЦИЯ ПО ЭКСПЛУАТАЦИИ
ДИАЛИЗАТОР ASAHI СЕРИИ REXEEDTM-A
1. ПОКАЗАНИЯ КПРИМЕНЕНИЮ
Диализатор Asahi серии REXEEDTM-A (далее - диализатор REXEED-A)
предназначен для проведения гемодиализа (ГД), гемодиафильтрации (ГДФ)
игемофильтрации (ГФ) больным сострой или хронической почечной
недостаточностью.
2. ПРОТИВОПОКАЗАНИЯ
Известных противопоказаний не имеет. На применение прибора
распространяются общие противопоказания кпроведению ГД, ГФ, ГДФ.
3. НЕЖЕЛАТЕЛЬНЫЕ РЕАКЦИИ
• Вслучае развития убольного нежелательной реакции немедленно
обратитесь кответственному врачу.
• Унекоторых больных во время проведения процедуры возможно
развитие аллергических реакций. Ксимптомам ипризнакам
аллергической реакции относятся: одышка со свистящим дыханием,
остановка дыхания, зуд, прилив жара, тревожность, обильное
потоотделение, крапивница, локальное или общее покраснение кожи,
отек лица, кистей или ступней, гипертензия, гипотония, учащение пульса,
аритмия, глазная гиперемия игипестезия, жар, лейкопения,
тромбоцитопения
• Такие побочные эффекты, как гипертензия, гипотония, головная боль,
боль вгруди, боль вживоте, усталость итошнота, зачастую связаны с
гиповолемией или гиперволемией имогут быть предотвращены путем
тщательного контроля объема жидкости иэлектролитного баланса у
больного, атакже скорости кровотока итрансмембранного давления
(ТМД).
4. ПРЕДУПРЕЖДЕНИЯ
Следуйте следующим инструкциям иинструкциям производителя аппарата
для ГД. Несоблюдение инструкций может привести ктравме или
летальному исходу. Производитель не несет ответственности за
безопасность больного вслучае несоблюдения данных инструкций или
инструкций производителя аппарата для ГД. Необходимо, чтобы врач был
ознакомлен сданной инструкцией при выполнений процедуры.
Диализатор REXEED-A предназначен только для однократного
применения. Повторное использование REXEED-A может привести к
нежелательным реакциям убольного и/или сбоям вработе устройства.
Диализатор REXEED-A должен быть использован до даты окончания
срока хранения. См. дату окончания срока хранения на этикетке
диализатора REXEED-A.
Диализатор REXEED-A должен храниться вчистом исухом месте,
защищенном от прямого солнечного света, тепловых излучений ивлаги,
при температуре 0-30°C (32-86°F).
Поставляемый производителем диализатор REXEED-A, наполнен
жидкостью. Эту жидкость не следует замораживать. Диализатор
REXEED-A сзамороженной жидкостью непригоден для эксплуатации,
даже после таяния жидкости.
Диализатор REXEED-A изготовлен из пластика иво время
транспортировки, хранения иэксплуатации не должен подвергаться
вибрации или механическим ударам.
REXEED-A нельзя подвергать воздействию органических
растворителей, таких как спирт, во избежание появления трещин или
деформации.
Перед применением диализатор REXEED-A следует осмотреть. При
наличии признаков повреждения устройства, повреждения или
нарушения герметичности стерилизационного пакета, утечки жидкости
из диализатора REXEED-A встерилизационный пакет, смещения или
отсоединения пробок устройство подлежит замене.
Перед использованием диализатора REXEED-A следует промыть
отделения для крови идля диализата сучетом описанных ниже
процедур заполнения диализатора.
Во время заполнения диализатора ипри проведении лечебной
процедуры следует соблюдать принципы асептики.
Не удаляйте жидкость до промывания инаполнения отделений для
крови физиологическим раствором во избежание попадания воздуха в
диализатор REXEED-A.
Физиологический раствор должен быть стерильным иапирогенным.
Из-за высокого коэффициента ультрафильтрации диализатор
REXEED-A необходимо применять только на аппаратах для ГД,
оборудованных контроллером ультрафильтрации (см. инструкции по
эксплуатации аппарата для ГД).
Диализат должен соответствовать областным стандартам или
стандартам ISO на качество воды для диализа, чтобы свести к
минимуму риск нежелательных реакций.
Рекомендуется использовать гнездовые соединители для портов крови и
портов для диализата, соединенные слиниями крови идиализата,
которые были разработаны всоответствии со стандартами ISO
8637:2004 иISO 8638:2004.
Перед началом процедуры на аппарате для ГД, проверьте соответствие
состояния индикатора, детектора извуковых сигналов, включая
воздухоподаватель идетектор кровеизливания, синструкцией
производителя по эксплуатации аппарата для ГД.
Во время заполнения следует полностью удалить воздух из диализатора
REXEED-A илиний крови; впротивном случае во время лечебной
процедуры возможно тромбообразование. Также недопустимо
попадание воздуха свозвратным током крови всосудистое русло
больного.
Во время заполнения диализатора ипри проведении лечебной
процедуры убедитесь вотсутствии утечек из диализатора, линий и
портов крови, атакже соединяющих их элементов. При обнаружении
утечки замените диализатор или линии крови.
Если диализат необходимо использовать вместо физиологического или
замещающего раствора, следует уделить особое внимание его
соответствию стандартам качества ичистоты воды (например,
требованиям стандарта ISO 11663:2009 на диализат для инфузий).
При возникновении осложнений, таких как утечка крови или
тромбообразование, следует под руководством врача немедленно
прекратить процедуру изаменить вышедший из строя диализатор
REXEED-A новым заполненным устройством.
REXEED-A имеет многоканальные соединяющие элементы. Ошибочное
соединение несоответствующего элемента может привести к
неполноценному лечению, травме или летальному исходу врезультате
утечки крови или лечебной жидкости
REXEED-A может удалить медикаменты, введенные вартериальную
кровяную линию. Следует вводить медикаменты на участке после
диализатора, если нет иных указаний.
Не допускать повышения ТМД сверх 500 мм рт. ст. (66 кПа), при этом
ТМД должен соответствовать ISO 8637:2004.
При планировании процедур для больных следует учитывать
рекомендуемые диапазоны значений параметров процедур, указанные в
ПРИЛОЖЕНИИ.
Утилизация использованного диализатора REXEED-A илиний крови
должна проводиться встрогом соответствии сгосударственными
нормами иправилами медицинского учреждения относительно
утилизации медицинских отходов.
5. ТЕХНИЧЕСКИЕ ИЭКСПЛУАТАЦИОННЫЕ ХАРАКТЕРИСТИКИ
Мембрана – REXBRANETM (полисульфон / поливинилпирролидон); корпус
инаконечники – блок-сополимер бутадиена истирола; пробки – полиэтилен
игидрогенизированный блок-сополимер бутадиена истирола; герметик –
полиуретан.
Стерилизовано гамма - излучением
Линия крови апирогенная.
Технические ирабочие характеристики вусловиях in vitro для отдельных
моделей REXEED-A см. вПРИЛОЖЕНИИ. Вклинических условиях
характеристики работы прибора REXEED-A могут отличаться от
характеристик вусловиях in vitro. Эти характеристики могут варьироваться
взависимости от условий ипродолжительности курса лечения.
6. ПРИМЕНЕНИЕ АНТИКОАГУЛЯНТОВ
Необходимость вприменении антикоагулянтов зависит от состояния
больного. Тип, дозу испособ введения антикоагулянтов должен определять
врач, владеющий информацией осостоянии больного.
7. ПОРЯДОК РАБОТЫ
1. ЗАПОЛНЕНИЕ ДИАЛИЗАТОРА
Можно поменять местами процедуры 2) и3).
1) Установите диализатор REXEED-A вдержателе вертикально, красным
наконечником (артериальный конец) вниз.
2) Подсоедините артериальную линию крови кпакету сфизиологическим
раствором для инфузий иполностью заполните артериальную линию
крови физиологическим раствором. Подсоедините артериальную и
венозную линии крови квходному ивыходному портам крови. В
половолоконный фильтр илинии крови не должен попасть воздух.
Промойте половолоконный фильтр илинии крови физиологическим
раствором вколичестве не менее 1000 мл со скоростью около 100
мл/мин. Если вдиализаторе или линиях крови остался воздух, добавьте
физиологический раствор для промывки, аккуратно постукивая рукой
по диализатору или перекрывая иоткрывая линии крови до полного
устранения воздуха. Не пытайтесь устранить воздух путем
постукивания по диализатору твердыми предметами, например
хирургическими щипцами, поскольку это может привести к
повреждению диализатора.
3) Подсоедините линии диализата кпортам для диализата. Откройте
подачу диализата со скоростью около 500 мл/мин не менее чем на 2
минуты. Для процедур ГДФ подсоедините замещающую линию кпорту
замещения изаполните ее.
• Описание процедуры заполнения для ГФ может быть получено по
запросу.
• Вместо физиологического раствора для заполнения изавершения
процедуры может применяться диализат для инфузий.
2. НАЧАЛО ПРОЦЕДУРЫ
1) Подсоедините артериальную линию крови картериальной канюле
больного. Включите насос крови на скорости около 100 мл/мин, чтобы
вытеснить физиологический раствор.
2) Подсоедините венозную линию крови квенозной канюле больного.
• При выполнении ГДФ необходимо внимательно наблюдать за скоростью
тока ультрафильтрата под руководством врача, знакомого ссостоянием
больного.Унекоторых больных, например свысокими показателями
гематокрита, большая скорость тока ультрафильтрата может вызвать
повышение кровяного давления на входе.
3. ЗАВЕРШЕНИЕ ПРОЦЕДУРЫ
1) Скорректировав скорость тока ультрафильтрата, остановите насос
крови.
2) Извлеките артериальную канюлю больного иподсоедините
артериальную линию крови кпакету сфизиологическим раствором.
Включив насос крови на малую скорость, закачайте вполоволоконный
фильтр ивлинии крови 100-200 мл физиологического раствора, чтобы
вытеснить кровь больного.
3) Пережмите венозную линию крови иизвлеките венозную канюлю
больного.
8. ГАРАНТИЯ ПРОИЗВОДИТЕЛЯ ИОГРАНИЧЕННАЯ
ОТВЕТСТВЕННОСТЬ
• Производитель гарантирует, что диализатор REXEED-A изготовлен в
соответствии сзаявленными техническими характеристиками иотвечает
стандартам ISO 9001:2008, ISO 13485:2003, другим применимым
промышленным стандартам инормам, атакже законодательным
требованиям.
• При обнаружении производственного брака или признаков повреждения
диализатора REXEED-A во время транспортировки об этом следует
сообщить представителю производителя. Через своих представителей
производитель прибора производит замену всего дефектного или
поврежденного оборудования.
• Производитель не несет ответственности за нанесенный ущерб, если его
причиной явилось повторное использование REXEED-A, нарушение
правил его эксплуатации, неправильное обращение сприбором,
несоблюдение предупреждений иинструкций, ущерб, причиненный
после отпуска изделия потребителю, невыполнение проверки состояния
прибора перед его применением. Производитель также не несет
ответственности по гарантийным обязательствам независимых
дистрибьюторов.

12
TÜRKÇE
HEMODİYALİZÖR KULLANIM TALİMATLARI
ASAHI REXEEDTM-A SERİSİDİYALİZÖR
1. KULLANIM ENDİKASYONU
Asahi REXEEDTM-A serisi diyalizör (bundan sonra REXEED-A olarak
bahsedilecektir) akut veya kronik böbrek yetmezliği olan hastaların tedavisi
için hemodiyaliz (HD), hemodiyafiltrasyon (HDF) ve hemofiltrasyonda
(HF) kullanım için endikedir.
2. KONTRENDİKASYONLAR
Bilinen herhangi bir kontrendikasyon yoktur. Genel olarak HD, HDF ve HF
için kontrendikasyonlar geçerlidir.
3. YAN ETKİLER
• Herhangi bir yan etki meydana geldiğinde derhal sorumlu bir hekime
başvurun.
• Bazıhastalar tedavi sırasında aşırıduyarlılık reaksiyonlarıyaşayabilir.
Hırıltıile birlikte akut nefes darlığı; solunum durması; kaşınma; hararet;
ruhsal durum bozukluğu; anormal terleme; ürtiker; genel veya lokal cilt
kızarıklığı; yüz, eller veya ayaklarda ödem; hipertansiyon; hipotansiyon;
nabız atışhızında artışritim bozukluğu; oküler hiperemi; hipoestezi; ateş;
lökopeni ve trombositopeni gibi semptomlar veya belirtiler ortaya
çıkabilir.
• Hipovolemi veya hipervolemi ile ilişkili olabilecek hipertansiyon,
hipotansiyon, başağrısı, göğüs ağrısı, karın ağrısı, yorgunluk, mide
bulantısıgibi yan etkiler genellikle hastanın sıvımiktarı, elektrolit
dengesi, kan akışhızıve transmembran basıncı(TMP) dikkatlice
denetlenirse önlenebilir.
4. UYARILAR
Bu talimatlara ve HD cihazıtedarikçisinin talimatlarına uyun. Uygunsuz
kullanım yaralanma veya ölüme neden olabilir. Bu talimatlara ve HD cihazı
tedarikçisinin talimatlarına uyulmazsa imalatçıhasta güvenliğine karşı
sorumlu olmayacaktır. Bu talimatların tedavi alanında operatörün elinde
bulunduğundan emin olun.
REXEED-A tek kullanımlıktır. REXEED-A’nın yeniden işlenmesi
hastada yan etkilere ve/veya üründe arızalanmaya yol açabilir.
KullanıcıREXEED-A’yıson kullanım tarihinden önce kullanmalıdır.
Son kullanım tarihi için REXEED-A ürün etiketine bakınız.
REXEED-A temiz, kuru bir ortamda doğrudan güneşışığı, ısıve
nemden uzak tutularak 0-30°C (32-86°F) sıcaklık aralığında
saklanmalıdır.
REXEED-A, imalatçıtarafından, sıvıdolu halde gönderilir. Bu sıvının
donmasına izin verilmemelidir. İçindeki sıvıdonmuşolan REXEED-A,
sıvıtekrar çözülse bile bundan sonra asla kullanılmamalıdır.
REXEED-A plastik bir üründür. Nakliye, saklama ve kullanım sırasında
titreşim ve darbelere maruz bırakılmamalıdır.
REXEED-A, alkol ve benzeri organik solventlere maruz
bırakılmamalıdır. Aksi takdirde çatlaklar ve deformasyonlar oluşur.
Her kullanımdan önce REXEED-A’yıkontrol edin, hasar, sterilizasyon
torbasında hasar veya uygunsuz contalama, REXEED-A’dan
sterilizasyon torbasıiçine sıvısızıntısıveya tıpalarında yanlışhizalama
veya ayrılma gibi hasar belirtileri gösteriyorsa yenisiyle değiştirin.
REXEED-A’nın diyalizat ve kan bölmelerinin kullanımdan önce aşağıda
açıklanan kullanıma hazırlama prosedürüne göre yıkandığından emin
olun.
Kullanıma hazırlama ve tedavi boyunca aseptik teknik kullanın.
REXEED-A’ya hava girmesini önlemek için kan bölmesini serum
fizyolojik ile yıkamadan ve doldurmadan önce sıvıyıboşaltmayın.
Serum fizyolojik, steril ve pirojenik olmayan fizyolojik bir solüsyon
olmalıdır.
REXEED-A yüksek ultrafiltrasyon katsayısına sahip olduğundan dolayı,
sadece UF kontrolörü bulunan HD cihazlarıile kullanılmalıdır (HD
cihazıtalimatlarına bakınız).
Diyalizin yan etki riskini en aza indirgemesi için diyalizatın bölgesel
veya ISO su kalitesi standartlarınıkarşılamasıgerekir.
ISO 8637:2004 ve ISO 8638:2004’e uygun olarak tasarlanan kan ve
diyalizat hatlarına takılıkan ve diyalizat portu konnektörlerinin (dişi)
kullanılmasıönerilir.
Tedaviye başlamadan önce, venöz hava sensörü ve kan sızıntıdetektörü
dâhil olmak üzere HD cihazıüzerindeki sensörlerin, dedektörlerin ve
alarm sisteminin HD cihazıtalimatlarına göre uygun çalışma durumunda
olmasınısağlayın.
Kullanıma hazırlama sırasında REXEED-A ve kan hatlarından havanın
tamamen tahliye edilmesini sağlayın; havanın tahliye edilmemesi tedavi
sırasında kan pıhtılaşmasına neden olabilir. Ayrıca, kan dönüşü sırasında
hastanın kan damarına hava girmemesini sağlayın.
Kullanıma hazırlama ve tedavi sırasında diyalizörden, kan hatlarından,
kan portlarından ve bunların bağlantıparçalarından sızıntıolmadığından
emin olun. Sızıntıvarsa diyalizörü veya kan hatlarınıdeğiştirin.
Serum fizyolojik veya replasman sıvısıyerine diyalizat kullanılacaksa,
diyalizat saflığının yürürlükteki su kalitesi standartlarına uygun olmasını
sağlamak için gereken özen gösterilmelidir (örneğin, ISO
11663:2009’da tanımlanan infüzyon için kullanılan diyalizat).
Tedavi sırasında kan sızıntısıveya koagülasyon gibi bir sorun olması
durumunda, bir hekimin direktifi altında tedaviyi derhal durdurun ve
REXEED-A’yıyeni kullanıma hazırlanmışbir diyalizör ile değiştirin.
REXEED-A’nın çoklu bağlantınoktalarıvardır. Uygun bağlantıların
yapılmaması, kan veya tedavi sıvısısızıntısından dolayı, tedavinin
tehlikeye sokulması, yaralanma veya ölüme neden olabilir.
REXEED-A arteryel kan hattına verilen ilaçlarıçıkarabilir. Aksine
talimat verilmedikçe, diyalizörden sonra ilaçlarıverin.
TMP’nin 500 mmHg’yi (66 kPa) aşmasına izin vermeyin, burada TMP
ISO 8637:2004’te tanımlanan şekilde olacaktır.
Hastalar için tedavi planlanırken, EK’te tanımlanan tedavi parametreleri
için önerilen aralıklar dikkate alınmalıdır.
Kullanılan REXEED-A ve kan hatlarınıkesinlikle tıbbi atıkların yok
edilmesi için belirlenmişresmî ve kurumsal standartlara uygun bir
şekilde elden çıkarın.
5. SPESİFİKASYONLAR VE PERFORMANS
Membran, REXBRANETM (Polisülfon / PVP); Gövde ve başlıklar,
Stiren-bütadien blok kopolimer; Tıpalar, Polietilen ve hidrojenize
stiren-bütadien blok kopolimer; Birleştirici materyal, Poliüretan
Gama ışınlarıile sterilize edilmiştir
Kan yolu pirojenik olmayan.
REXEED-A modelleri ile ilgili tasarım spesifikasyonlarıve in vitro
performans bilgisi için EK bölümüne bakınız. Bir klinik ortamda,
REXEED-A performansıin vitro’dan farklıolabilir; bu farklılığın nedeni
tedavi koşullarına ve süresine bağlıdır.
6. ANTİKOAGÜLASYON
Antikoagülant gereksinimleri hastanın durumuna bağlıolarak değişecektir;
antikoagülant tipi, miktarıve antikoagülant verilme yöntemi hastanın
durumunu bilen bir hekimin direktifleri doğrultusunda belirlenmelidir.
7. ÇALIŞTIRMA
1. KULLANIMA HAZIRLAMA
• 2) ve 3) işlemlerin sırasıdeğiştirilebilir.
1) REXEED-A’yıdikey olarak tutucunun içine, kırmızıbaşlık (arteryel uç)
aşağıgelecek şekilde yerleştirin.
2) Arteryel kan hattınıinfüzyon için serum fizyolojik torbasına bağlayın ve
arteryel kan hattınıserum fizyolojik ile doldurun. Arteryel ve venöz kan
hatlarınıkan girişve çıkışportlarına bağlayın. İçi boşfiberler ile kan
hatlarının içine hava girmemesine dikkat edin. İçi boşfiberleri ve kan
hatlarınıen az 1000 mL serum fizyolojik ile yaklaşık 100 mL/dk akışta
yıkayın. Diyalizörde veya kan hatlarında hava varsa, yıkamak için
fazladan serum fizyolojik uygulayın ve aynıanda hava çıkana kadar bir
elinizle diyalizöre hafifçe vurun ya da kan hatlarınısıkıştırıp bırakarak
havayıboşaltın. Havayıboşaltmak için pense gibi sert aletlerle
diyalizöre vurmayın; aksi takdirde diyalizör hasar görebilir.
3) Diyalizat hatlarınıdiyalizat portlarına bağlayın. Diyalizatın yaklaşık 500
mL/dk akışta 2 dakika veya daha uzun süre boyunca akmasına izin verin.
HDF için replasman hattınıreplasman portuna bağlayın, ardından hattı
kullanıma hazırlayın.
• Talep üzerine HF için farklıbir kullanıma hazırlama prosedürü alınabilir.
• Kullanıma hazırlamak ve tedaviyi sonlandırmak için serum fizyolojik
yerine infüzyon diyalizatıkullanılabilir.
2. TEDAVİNİN BAŞLATILMASI
1) Arteryel kan hattınıhastanın arteryel kanülüne bağlayın. Serum
fizyolojiğin yerini almasıiçin kan pompalamaya (yaklaşık 100 mL/dk)
başlayın.
2) Venöz kan hattınıvenöz kanüle bağlayın.
• HDF için ultrafiltrasyon akışhızı, hastanın durumunu yakından bilen bir
doktorun gözetiminde dikkatle izlenmelidir. Hematokrit değeri yüksek
olanlar gibi bazıhastalarda yüksek ultrafiltrasyon hızıkan giriş
basıncının artmasına neden olabilir.
3. TEDAVİNİN SONLANDIRILMASI
1) UF akışhızınıayarlayın ve kan pompasınıdurdurun.
2) Arteryel kanülü hastadan çıkarın ve arteryel kan hattınıserum fizyolojik
torbasına bağlayın. Hastanın kanınıgeri temizlemek için kan pompasını
yavaşça sıkmaya başlayarak içi boşfiberler ve kan hatlarının içine
100-200 mL serum fizyolojik verin.
3) Venöz kan hattınıklempleyin ve venöz kanülü hastadan çıkarın.
8. GARANTİVE SINIRLI SORUMLULUK
• İmalatçı, REXEED-A’nın spesifikasyonlarına, ISO 9001:2008, ISO
13485:2003’e, uygulanabilir endüstriyel standartlara ve yönetmelik
gereklerine göre uygun bir şekilde üretildiğini garanti eder.
• Üretim veya nakliye sırasında meydana gelmişherhangi bir hata imalatçı
firma temsilcisinin dikkatine sunulursa, imalatçıtemsilcisi aracılığıyla
REXEED-A’yıyenisiyle değiştirecektir.
• İmalatçı; REXEED-A cihazlarının tekrar kullanımı, yanlışkullanımı,
uygun olmayan muameleye maruz kalması, uyarıve talimatlara uymama
sonucu meydana gelen herhangi bir hasar, ürün piyasaya sürüldükten
sonra meydana gelen olayların neden olduğu hasar, ürünün kullanımdan
önce uygun durumda olduğunu kontrol etmeyi ihmal ettiğiniz takdirde
meydana gelen arızalara veya bağımsız dağıtıcılar tarafından verilen
herhangi bir garantiye karşısorumlu değildir.

13
中文
血液透析器 ASAHI REXEEDTM-A 系列透析器使用說明書
1. 適應症
Asahi REXEEDTM-A 系列透析器(以下簡稱 REXEED-A)適
用於急慢性腎衰竭患者的血液透析(HD)、血液透析過濾
(HDF)及血液過濾(HF)治療。
2. 禁忌症
尚無資料。一般而言,HD、HDF 及HF 的禁忌症均適用。
3. 副作用
• 當發生副作用時,請立即向主治醫師報告。
• 治療期間,部分患者可能會發生過敏性反應。具體症狀和
徵候包括:伴有喘鳴聲的急性呼吸困難、呼吸停止、皮膚
搔癢、臉潮紅、情緒不佳、異常出汗、蕁麻疹、全身或局
部性皮膚潮紅、臉部或手脚水腫、高血壓、低血壓、心搏
過速、心律不整、眼睛充血、感覺遲鈍、發燒、白血球减
少和血小板减少。
• 對於可能與低血容量症或高血容量症有關的高血壓、低血
壓、頭痛、胸痛、胃痛、疲勞、噁心等副作用,通常可以
藉由嚴密監控患者的體液容積、電解質平衡狀況、以及調
整血流速度和膜上壓(TMP)予以有效預防。
4. 警告
請遵照本使用說明書與 HD 機廠商規定操作。不當使用將會導
致病患損傷或死亡。若未遵照本說明書與 HD 機廠商規定使
用,而危害病患安全,則本製造商不負任何責任。請確實將此
些說明書內容轉告使用單位的操作者。
REXEED-A 僅限單次使用。重複處理 REXEED-A 可能導
致患者產生副作用或器材故障。
REXEED-A 須在有效日期前使用。有效日期請參閱
REXEED-A 產品標籤。
REXEED-A 應存放在清潔乾燥與避免陽光直射、高溫潮濕
且溫度控制在 0-30°C(32-86°F)間之環境。
REXEED-A 出廠時容器內充滿液體。絕不可讓該液體結凍。
液體凍結或者曾解凍過的 REXEED-A,均絕對禁止使用。
REXEED-A 為塑膠製品,在運輸、儲存或操作過程中,請
勿振動或撞擊。
避免讓 REXEED-A 接觸酒精等有機溶劑,防止裂開或變形。
使用前應仔細檢查每個 REXEED-A 狀態,如有損壞跡象、
滅菌袋破裂或密封不全、滅菌袋內有 REXEED-A 液體外漏、
蓋子移位或脫落等其中一項時,應更換新的 REXEED-A。
使用前應先遵照下述預充步驟將 REXEED-A 內部的透析液
腔室和血液腔室沖洗乾淨。
預充和治療期間皆應採用無菌技術執行。
使用生理食鹽水沖洗和充填血液腔室前,請勿移除容器內
原有的液體,以免空氣進入 REXEED-A。
生理食鹽水必須是無菌和無致熱原之生理溶液。
因REXEED-A 具有很高的超過濾係數,故僅適用於內建
UF 控制器的 HD 機(請參閱 HD 機操作手冊)。
透析液必須符合當地或 ISO 透析用水質標準,儘量減少副
作用發生。
建議使用符合 ISO 8637:2004 和ISO 8638:2004 規範的與
透析迴路管銜接的血液和透析液接口埠接頭(母接頭)。
開始治療前,請遵照 HD 機器的操作說明書執行,確認 HD
機器上包括靜脈端的空氣感應器與漏血偵測器等感應器、
偵測器與警報系統處於正常運行狀態。
預充時應將 REXEED-A 和血液迴路管內的空氣確實排空,
如未完全排空,則可能導致治療期間發生凝血現象。另外,
回血時,也應避免空氣進入患者血管內。
預充和治療期間,確保透析器、血液迴路管、血液接口埠
及其銜接部位皆不可有外漏現象。如果發現外漏,應立即
更換透析器或血液迴路管。
若以透析液取代生理食鹽水或置換液使用時,應小心確認
其純度是否符合規定的水質標準(例如,灌注用透析液之
純度在 ISO 11663:2009 中有規定)。
治療期間如發生血液外漏或凝血等情況時,應遵照醫師指
示立即中止治療,並以預充過的新透析器置換原有的
REXEED-A。
REXEED-A 上有多個銜接埠接頭。若銜接不當,可能因血
液或治療液外漏,導致中斷治療、患者損傷或死亡。
REXEED-A 可能會將從動脈端血液迴路管所投與的藥物洗
掉,因此除非有醫囑指示,否則請在透析器後方的靜脈端
回路管給藥。
根據 ISO 8637:2004 中規定,TMP 不得超過 500 mmHg
(66 kPa)。
開立患者治療處方時,應參考附錄中的建議治療參數範圍。
處置已用過的 REXEED-A 和血液迴路管,應嚴格遵照醫療
廢棄物處理標準等法規執行。
5. 規格與性能
薄膜:REXBRANETM (聚碸 / PVP);容器和頂蓋:苯乙烯
丁二烯聚合物;蓋子:聚乙烯與氫化苯乙烯丁二烯聚合物;封
裝材料:聚胺甲酸酯
以γ射線滅菌
血液管路無致熱源。
請參閱規格/型號上各型號 REXEED-A 的設計規格和體外試驗
性能報告。臨床上,因治療狀況和時間不同,使得 REXEED-
A性能與體外試驗結果會產生些許差異。
6. 抗凝血作用
抗凝血劑的使用需根據患者的具體狀況進行調整,對於抗凝血
劑的類型、劑量、及服用方法應遵從熟悉患者狀況的醫師的指
示。
7. 操作
1. 預充(Priming)
操作步驟 2) 和3) 的順序可對調。
1) 將REXEED-A 以紅色頂蓋(動脈端)朝下,垂直放入固定
架上。
2) 將動脈端血液迴路管銜接生理食鹽水袋進行灌注,並將動
脈端血液迴路管用生理食鹽水填滿。將動脈端和靜脈端血
液迴路管分別與血液進出口埠銜接。此時須避免空氣跑入
中空纖維和血液迴路管中。以約 100 mL/min 的流速用至少
1000 mL 的生理食鹽水沖洗中空纖維和血液迴路管。如果透
析器或血液迴路管中有空氣殘留,請用生理食鹽水執行排
氣,其間可用雙手輕敲透析器或捏放血液迴路管,讓空氣
完全排空。請勿使用夾鉗等堅硬工具敲打透析器,避免透
析器損壞。
3) 將透析液迴路管銜接至透析液接口埠。並以約 500 mL/min
流速的透析液灌注 2分鐘以上。施行 HDF 治療時,需將置
換液迴路管和置換液接口埠銜接後,進行預充。
• 施行 HF 治療時,可視情況需要調整預充步驟。
• 可用透析液取代生理食鹽水進行預充和結束治療時。
2. 開始治療
1) 將動脈端血液迴路管與患者動脈端留置針銜接。啟動血液
幫浦(約 100 mL/min)讓血液置換生理食鹽水。
2) 將靜脈端血液迴路管與靜脈端留置針銜接。
• 施行 HDF 治療時,應遵從熟悉患者病情的醫師指示,嚴密
監控超過濾流速。過高的超過濾流速可能會造成某些像高
血球比容症患者血液入口壓力過高。
3. 結束治療
1) 調整 UF 流速並關閉血液幫浦。
2) 把患者身上的動脈端留置針拔掉,並將動脈端血液迴路管
銜接生理食鹽水袋。緩慢地開啟血液幫浦,100-200 mL 的
生理食鹽水注入中空纖維與血液迴路管中,讓血液返回病
患體內。
3) 用夾鉗關閉靜脈端血液迴路管後,將患者身上的靜脈端留
置針拔除。
8. 保證與有限責任
• 製造商保證 REXEED-A 是依照產品規格書內容生產,並符
合ISO 9001:2008、ISO 13485:2003 及相關工業標準與法規
要求。
• 如有任何因製造或運輸過程所導致的不良品,請通知代理
商,製造商將透過代理商為您更換新的 REXEED-A。
• 製造商對以下狀況不負任何法律責任:重複使用、錯誤使
用、操作不當、未遵守警告內容和操作說明規定使用、開
封使用後的產品損壞、使用前未仔細檢查產品狀態是否完
整、或未正式授權之經銷商所給予的任何保證。

14
한국어
혈액투석기 사용 설명서
아사히 REXEEDTM-A 시리즈 혈액투석기
1. 사용안내
아사히 REXEEDTM-A 시리즈 혈액투석기 (이하 REXEED-A 라고
함) 는 급성신부전 혹은 만성신부전을 앓고 계신 환자를 치료하기
위한 혈액투석 (HD), 혈액투석여과기법 (HDF), 혈액여과법 (HF)
에 사용할 것을 목적으로 하고 있습니다.
2. 금기
특히 없음. HD, HDF, HF 의 일반적인 금기가 적용됩니다.
3. 부작용
• 부작용이 발생하였을 때에는 즉시 담당의사와 상담하여
주십시오.
• 환자에 따라서는 치료 중에 과민 반응을 일으키는 경우가
있습니다. 증상이나 징후로서는 다음과 같은 것이
있습니다:천식을 동반한 심한 호흡곤란, 호흡정지, 가려움,
안면홍조, 불쾌감, 이상 발한, 담마진, 전신 혹은 국부 피부의
적열상태, 안면 ・손발의 부종, 혈압상승, 저혈압, 맥박 수 상승,
부정맥, 눈의 충혈, 촉각 둔마, 발열, 백혈구 감소, 혈소판 감소.
• 순환혈액량 감소 혹은 순환혈액량 과다에 수반되는 부작용,
예를 들면 혈압상승, 저혈압, 두통, 가슴 통증, 복통, 피로감,
구토 등은 환자의 체액량, 전해질 밸런스, 혈류량 및 막간압
(TMP) 을 주의 깊게 관리함으로써 일반적으로 예방할 수
있습니다.
4. 경고
본취급 설명 및HD 장치 제조회사의 취급 설명을 따라주시기
바랍니다. 부적절한 사용은 부상이나 사망의 원인이 될 수
있습니다. 본 취급 설명 및 HD 장치 제조회사의 취급 설명을
따르지 않을 시의 환자의 안전에 대하여 제조회사는 일체의
책임을 지지 않습니다. 반드시 본 취급 설명을 치료시 의사가
확인할 수 있도록 하십시오.
REXEED-A 는 일회용을 목적으로 하고 있습니다. REXEED-A
를 재생처리하여 사용한 경우, 환자에게 부작용을 유발하거나
제품이 고장을 일으킬 가능성이 있습니다. REXEED-A 를
재사용하지 마십시오.
REXEED-A 는 유통기한 내에 사용하셔야 합니다. 유통기한은
REXEED-A 제품 라벨을 참조하십시오.
REXEED-A 는 직사광선, 열, 습도를 피하고 깨끗하고 건조한
환경에 두며 온도는 0-30°C (32-86°F) 로 유지해야 합니다.
REXEED-A 는 제조업자가 출하할 때에 액체로 채워져
있습니다. 이 액체를 동결시켜서는 안됩니다. 녹인 후라
하더라도 한번 동결되었던 액체로 채워진 REXEED-A 는
사용해서는 안됩니다.
REXEED-A 는 플라스틱 제품이므로 수송 중, 보관 중, 취급
중에 진동, 충격을 받아서는 안됩니다.
REXEED-A 의 파손 혹은 변형을 막기 위해 알콜 등의
유기용액에 노출시키지 마십시오.
각 REXEED-A 는 사용하기 전에 검사하여 주십시오. 손상,
멸균백의 손상 혹은 부적절한 밀봉, REXEED-A 로부터
멸균백으로의 액체 누출 혹은 연결구캡의 어긋남이나 빠짐
등의 징후가 있는 경우에는 REXEED-A 를 교환하여 주십시오.
아래의 충진 순서에 따라 사용하기 전에 REXEED-A 의 투석액
측과 혈액 측을 확실히 세정하여 주십시오.
충진 중 또는 치료 중에는 무균 기술을 사용하여 주십시오.
REXEED-A 로의 공기 유입을 방지하기 위해 생리식염액으로
혈액 측을 세정한 다음 충진하기 전에 액체를 빼지 말아
주십시오.
생리식염액은 반드시 멸균 및 비발열성인 생리적 용액이어야
합니다.
초 여과 계수가 높으므로 반드시 UF 컨트롤러를 갖춘 HD 와
함께 REXEED-A 를사용하셔야 합니다 (HD 장치의 취급
설명서를 참조하여 주십시오).
부작용의 위험을 최소화하기 위해 투석액은 각 지역 또는 ISO
의 투석용 수질 기준을 만족해야 합니다.
ISO 8637:2004 및ISO 8638:2004 에 명시된 대로 설계된 혈액 및
투석액 라인과 연결된 혈액 및 투석액 포트 연결구 (암)
사용을 권장합니다.
치료 시작 전에 정맥에어센서와 혈액누설탐지기를 포함해 HD
장치의 감지기, 탐지기와 경보시스템이 HD 장치의 취급
설명과 일치하는 정상 작동상태에 있는지 반드시 확인하여야
합니다.
충진 시에, REXEED-A 및 혈액 라인에 공기가 완전히
제거되었음을 확인하여 주십시오. 공기 제거에 실패하면 치료
중에 혈액 응고를 야기할 우려가 있습니다. 나아가 혈액 회수
중에 환자의 혈관에 공기가 유입되지 않도록 확인하여
주십시오.
충진 및 치료 시, 혈액투석기, 혈액 라인, 혈액 포트 및
연결부에서 누출이 없는지 확인합니다. 만약 누출이 발견되면
혈액투석기 또는 혈액 라인을 교체합니다.
생리식염액 또는 대체액 대신 투석액을 사용하는 경우에는
투석액의 순도가 적용되는 수질 기준 (예를 들어 ISO
11663:2009 에 명시된 정맥 주입용 투석액) 에 부합되도록
주의를 기울여야 합니다.
치료 중에 혈액 누출, 혈액 응고 등의 문제가 있는 경우에는
의사의 지시 아래 즉시 치료를 중지하고 충진 준비를 마친
새로운 REXEED-A 와 교체하여 주십시오.
REXEED-A 에는 여러 연결 부위가 있습니다. 적절하게
연결되지 않았을 시, 혈액 및 치료액의 누설로 치료질의 저하,
부상 또는 사망의 원인이 될 수 있습니다.
동맥 라인에 투여된 약제는 REXEED-A 에 의해 제거되는
경우가 있습니다. 따라서 지시가 없는 한 약제는 투석 치료 중
혈액투석기 다음에 정맥 라인에 투약해 주십시오.
ISO 8637:2004 에명시된 대로 TMP 가500 mmHg (66 kPa) 를
초과하지 않도록 주의하여 주십시오.
환자의 치료를 계획할 때 부록에 명시된 치료 파라미터의 권장
범위를 참조하여 주십시오.
사용이 끝난 REXEED-A 및 혈액 라인은 의료 폐기물 처리를
위한 공식 및 조직 기준을 엄격히 준수하여 처리하여
주십시오.
5. 사양과 성능
막, REXBRANETM (폴리설폰 / PVP); 케이스와 연결구,
스틸렌-부타디엔 블록 공중합체; 연결구캡, 폴리에틸렌 및 경화
스틸렌-부타디엔 블록 공중합체; 접착제, 폴리우레탄.
감마선에 의한 멸균
혈액라인은 비발열성입니다.
각REXEED-A 모델에 관해서는 설계사양 및 in vitro 의
성능정보를 위한 부록을 참조해 주십시오. 임상 환경에서
REXEED-A 의 성능은 in vitro 환경에서의 성능과 다를 수
있습니다. 이 성능은 치료의 상태 및 기간에 의해 달라질 수
있습니다.
6. 항응고
항응고제의 필요량은 환자의 상태에 따라 다르므로 항응고제
투여의 방법, 양, 종류는 환자의 상태를 숙지하고 있는 의사의
지시에 따르도록 합니다.
7. 조작
1. 충진
처치 2) 와3) 의 순서는 바꿀수 있습니다.
1) 적연결구 (동맥측) 를아래로 향하게 하여 REXEED-A 를 홀더
안에 수직으로 넣습니다.
2) 동맥용 혈액 라인을 생리식염액 백에 접속하여 주입할 수
있도록 하며, 동맥용 혈액 라인을 생리식염액으로 완전히
채웁니다. 동맥 라인과 정맥 라인을 혈액 입구와 혈액 출구에
연결합니다. 중공사와 혈액 라인에 공기가 들어가지 않도록
주의하십시오. 중공사와 혈액 라인은 약 100 mL/분의 속도로
적어도 1000 mL 의 생리식염액을 사용하여 세정하십시오. 만약
혈액투석기 또는 혈액라인에 공기가 들어가면 공기가 완전히
제거될 때까지 손으로 혈액투석기를 조심스럽게 톡톡 치거나
혈액라인을 죄었다 놨다 하면서 세척용 생리식염액을
추가합니다. 공기 제거 시 혈액투석기를 겸자와 같은 딱딱한
기구로 치게 되면 혈액투석기가 손상을 입게 되니 하지
마십시오.
3) 투석액 라인을 투석액 포트에 연결합니다. 투석액이 약 500
mL/분의 속도로 2분간 이상 흐르도록 합니다. HDF 에
대해서는 대체 라인을 대체 포트에 접속하여 라인을
충진합니다.
• HF 를 위한 별도 충진 절차를 요청하시면 제공이 가능합니다.
• 정맥 주입용 투석액을 생리식염액 대신 사용해 충진 및 치료를
종료할 수 있습니다.
2. 치료 개시
1) 동맥용 혈액 라인을 환자의 동맥용 캐뉼라에 연결합니다. 혈액
펌프 (약 100 mL/분)를 작동시켜 생리식염액을 제거합니다.
2) 정맥용 혈액 라인을 정맥용 캐뉼라에 연결합니다.
• HDF 에서 초 여과 유량은 환자의 상태를 숙지하고 있는 의사의
지시에 따라 주시해야 합니다. 환자 (예를 들어 헤마토크릿
수치가 높은 환자) 의 초 여과 유량이 높으면 혈액 입구 압력이
높아 질 수 있습니다.
3. 치료 종료
1) UF 유량을 조절하고 혈액 펌프를 정지시킵니다.
2) 동맥용 캐뉼라를 환자로부터 분리하고 동맥용 혈액라인을
생리식염액 백에 연결합니다. 환자의 혈액을 원래대로
회수하기 위해 혈액 펌프를 천천히 작동시켜 100 - 200 mL 의
생리식염액을 중공사 및 혈액라인에 주입합니다.
3) 정맥용 혈액 라인을 확실히 잠근 뒤 정맥 캐뉼라를 환자로부터
분리합니다.
8. 보증 및 유한 책임
• 제조회사는 ISO 9001:2008, ISO 13485:2003, 해당 산업 기준 및
규제 사항을 준수하고 있으며, REXEED-A 가제품 사양에 맞게
제조되고 있음을 보증합니다.
• 제조 중 혹은 수송 중에 일어난 결함이 제조회사
판매대리점에서 확인된 경우, 제조회사는 해당 판매대리점을
통해 새로운 REXEED-A 로 교체해 드립니다.
• REXEED-A 의 재사용, 오용, 부적절한 취급, 경고 및 취급
설명에 대한 위반으로 발생한 손상, 제품이 개봉된 후에 발생한
결함, 제품 사용 전 적절한 조건의 미확인으로 인해 발생한
손상 혹은 제조회사와 관계가 없는 독자 소매상이 부여한
보증에 대해서 제조회사는 일체 책임을 지지 않습니다.
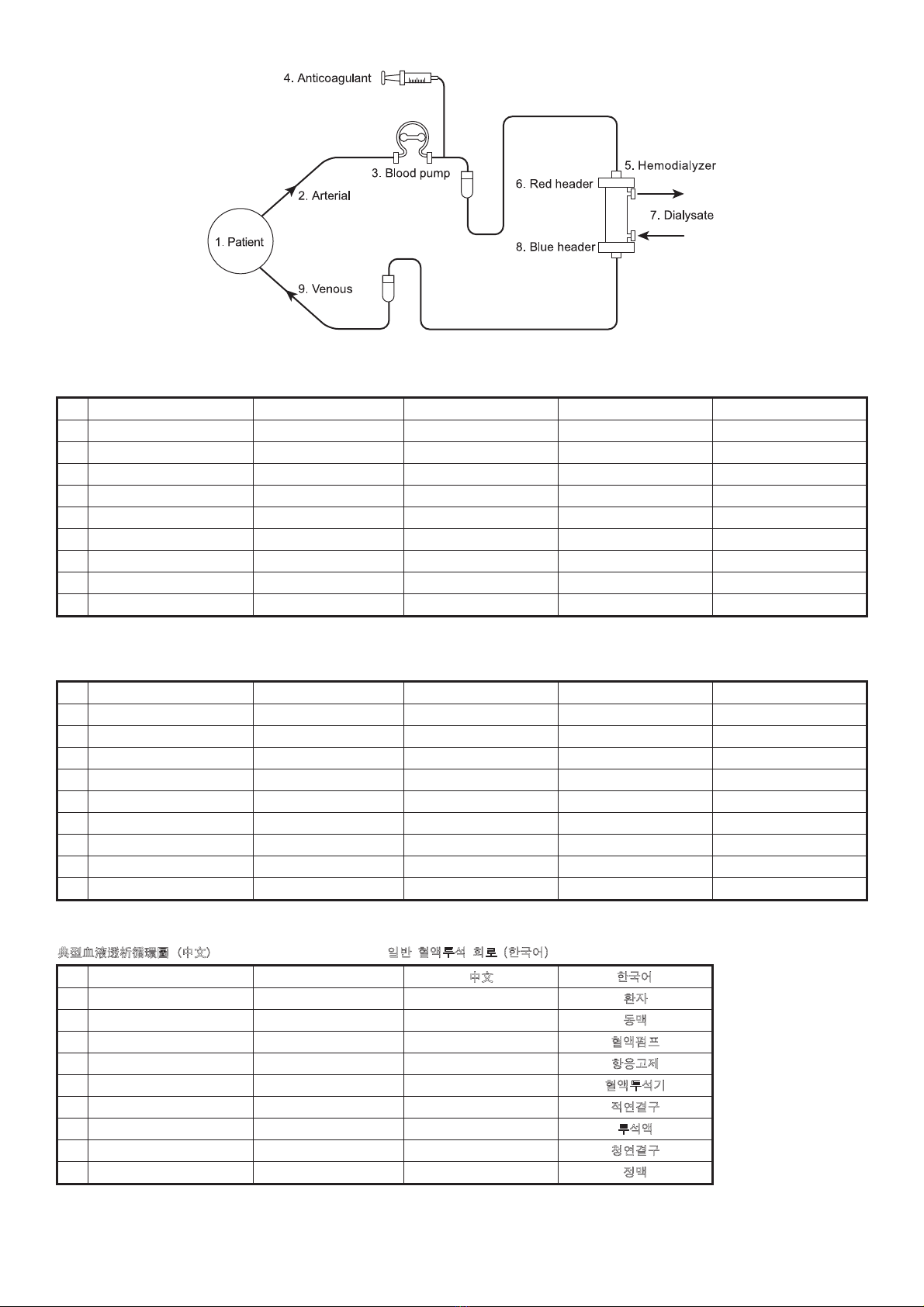
15
ENGLISH FRANÇAIS DEUTSCH ITALIANO ESPAÑOL
1 Patient Patient Patient Paziente Paciente
2 Arterial Tubulure artérielle Arteriell Arterioso Arterial
3 Blood pump Pompe sanguine Blutpumpe Pompa ematica Bomba de sangre
4 Anticoagulant Anticoagulant Antikoagulans Anticoagulante Anticoagulante
5 Hemodialyzer Hémodialyseur Hämodialysator Emodializzatore Hemodializador
6 Red header Tête rouge Rote Endkappe Testata rossa Cabezal rojo
7 Dialysate Dialysat Dialysat Dialisato Dializado
8 Blue header Tête bleu Blaue Endkappe Testata blu Cabezal azul
9 Venous Tubulure veineuse Venös Venoso Venoso
PORTUGUÊS NEDERLANDS SVENSKA SLOVENČINA ČEŠTINA
1 Paciente Patiënt Patient Pacient Pacient
2 Arterial Arteriële lijn Arteriell Arteriálny Tepenný
3 Bomba de sangue Bloedpomp Blodpump Krvná pumpa Krevní pumpa
4 Anticoagulante Antistollingsmiddel Antikoagulant Antikoagulant Antikoagulant
5 Hemodialisador Hemodialysator Hemodialysator Hemodialyzátor Hemodialyzátor
6 Cabeça vermelha Rode kop Rött huvud Červené označenie Červená hlavice
7 Dialisado Dialysaat Dialysat Dialyzát Dialyzát
8 Cabeça azul Blauwe kop Blått huvud Modré označenie Modrá hlavice
9 Venoso Veneuze lijn Venös Venózny Žilní
РУССКИЙ TÜRKÇE 中文 한국어
1 Больной Hasta 患者 환자
2 Артериальная магистраль Arteryel 動脈 동맥
3 Насос крови Kan pompası血液幫浦 혈액펌프
4 Антикоагулянт Antikoagülant 抗凝血劑 항응고제
5 Гемодиализатор Hemodiyalizör 血液透析器 혈액투석기
6 Красный наконечник Kırmızıbaşlık 紅色頂蓋 적연결구
7 Диализат Diyalizat 透析液 투석액
8 Голубой наконечник Mavi başlık 藍色頂蓋 청연결구
9 Венозная магистраль Venöz 靜脈 정맥
Typical hemodialysis circuit (ENGLISH) Circuit spécifique d’hémodialyse (FRANÇAIS) Typischer Hämodialysekreislauf (DEUTSCH)
Circuito tipico di emodialisi (ITALIANO) Circuito de hemodiálisis típico (ESPAÑOL)
Circuito típico de hemodiálise (PORTUGUÊS) Typisch hemodialyse circuit (NEDERLANDS) Typisk hemodialyskrets (SVENSKA)
Typický hemodialyzačný okruh (SLOVENČINA) Typický hemodialyzační okruh (ČEŠTINA)
Стандартная схема гемодиализа (РУССКИЙ) Tipik hemodiyaliz devresi (TÜRKÇE)
典型血液透析循環圖 (中文) 일반 혈액투석 회로 (한국어)

16
APPENDIX (ENGLISH) ANNEXE (FRANÇAIS) ANHANG (DEUTSCH)
APPENDICE (ITALIANO) APÉNDICE (ESPAÑOL)
Model numbers / Références du modèle / Modellnummern
/ Numeri modello / Códigos de modelo REXEED-13A REXEED-15A REXEED-18A REXEED-21A REXEED-25A
Clearances / Clairances / Freigaben / Clearance / Aclaramientos
• Qd = 500 mL / min, Qf = 0 mL / min Qb (mL / min)200 300 400 200 300 400 200 300 400 200 300 400 200 300 400
Urea / Urée / Harnstoff / Urea / Urea (mL / min) 194 264 306 196 272 317 198 280 330 199 284 340199 287 350
Creatinine / Créatinine / Kreatinin / Creatinina
/ Creatinina (mL / min) 188 247 284 191 255 296 194 265 309 195 272 317 196 280 330
Phosphate / Phosphate / Phosphat / Fosfati
/ Fosfatos (mL / min) 180227 259 185238 272 190 250 289 192 257 299 194 260 303
Vitamin B12 / Vitamine B12 / Vitamin B12 / Vitamina B12
/ Vitamina B12 (mL / min) 133 155 165142 168 179 152 183 197 160 194 212 163 199 225
Ultrafiltration coefficient / Coefficient d’ultrafiltration
/ Ultrafiltrationskoeffizient / Coefficiente di ultrafiltrazione
/ Coeficiente de ultrafiltración (mL / hr / mmHg (mL / hr / kPa)) 66 (495) 72 (540) 81 (608) 90 (675) 102 (773)
• Qb = 300 mL / min
• Bovine blood / Sang de bovin / Rinderblut / Sangue bovino
/ Sangre bovina
• Total protein / Protéines totales / Gesamtprotein / Proteine totali
/ Proteína total = 60 ± 5 g/L
• Hematocrit / Hématocrite / Hämatokrit / Ematocrito
/ Hematocrito = 32 ± 2 %
Pressure drop / Chute de pression / Druckabfall / Calo di pressione
/ Caída de presión (mmHg (kPa))
Blood side / Côté du sang / Blutseite / Lato del sangue
/ Lado de la sangre 135 (18) 117 (16) 98 (13) 84 (11) 71 (9)
• Qb = 300 mL / min
• Bovine blood / Sang de bovin / Rinderblut / Sangue bovino
/ Sangre bovina
• Total protein / Protéines totales / Gesamtprotein / Proteine totali
/ Proteína total = 60 ± 5 g/L
• Hematocrit / Hématocrite / Hämatokrit / Ematocrito
/ Hematocrito = 32 ± 2 %
Dialysate side / Côté du dialysat / Dialysatseite / Lato del dialisato
/ Lado dializado
• Qd = 500 mL / min
78 (10) 73 (10) 69 (9) 66 (9) 63 (8)
Priming volume / Volume d’amorçage / Füllvolumen
)Lm(odabecednemuloV/gnimirpidemuloV/ 76 86 103 117 137
Hollow fibers / Fibres creuses / Hohlfasern / Fibre cave / Fibras huecas
Effective surface area / Surface effective de la membrane
/ Faserwirkfläche / Area superficie effettiva
/ Área efectiva de fibra (m2) 1.3 1.5 1.8 2.1 2.5
Internal diameter / Diamètre interne / Innendurchmesser
(onretniortemáiD/onretniortemaiD/ μm) 185
Wall thickness / Epaisseur du mur / Wandstärke
/ Spessore della parete / Grosor de la pared (μm) 45
Sieving coefficient / Coefficient de tamisage / Filtrationskoeffizient
/ Coefficiente di setacciamento / Coeficiente de cribado
•Bovine plasma / Plasma de bovin / Rinderplasma
/ Plasma bovino / Plasma bovino
• Total protein / Protéines totales / Gesamtprotein
/ Proteine totali / Proteína total = 60 ± 5 g/L
0.1anilunI/anilunI/nilunI/enilunI/nilunI
β2-microglobulin / β2-microglobuline / β2-Microglobulin
/ β2-microglobulina / β2-microglobulina 0.8
Myoglobin / Myoglobine / Myoglob 4.0anibolgoiM/anibolgoiM/ni
100.0animúblA/animublA/nimublA/enimublA/nimublA
odemúH/otangaB/ssaN/edimuH/teWopiT/opiT/pyT/epyT/epyT
Flow and pressure limits / Limites de débit et de pression
/ Fluss- und Druckbegrenzungen / Limiti flusso e pressione
/ Límites de flujo y de presión
Max. transmembrane pressure / Pression transmembranaire max.
/ Max. Transmembrandruck / Pressione transmembrana max.
/ Presión transmembrana máx. (mmHg (kPa)) 500 (66)
Max. blood flow / Débit maximal du sang
/ Max. Blutfluss / Flusso massimo sangue
)nim/Lm(omixámoeníugnasojulF/ 500
Max. dialysate flow / Débit maximal du dialysat
/ Max. Dialysatfluss / Flusso massimo dialisato
)nim/Lm(odazilaidledomixámojulF/ 800
ISO 8637:2004

17
APÊNDICE (PORTUGUÊS) BIJLAGE (NEDERLANDS) BILAGA (SVENSKA)
PRÍLOHA (SLOVENČINA) PŘÍLOHA (ČEŠTINA)
Números dos modelos / Modelnummers / Modellnummer
/ Čísla modelov / Čísla modelůREXEED-13A REXEED-15A REXEED-18A REXEED-21A REXEED-25A
Depurações / Klaringen / Clearances / Klírens / Clearance
• Qd = 500 mL / min, Qf = 0 mL / min Qb (mL / min)200 300 400 200 300 400 200 300 400 200 300 400 200 300 400
Ureia / Ureum / Urinämne / Urea / Močovina (mL / min) 194 264 306 196 272 317 198 280 330 199 284 340199 287 350
Creatinina / Creatinine / Kreatinin / Kreatinín
/ Kreatinin (mL / min) 188 247 284 191 255 296 194 265 309 195 272 317 196 280 330
Fosfato / Fosfaat / Fosfat / Fosfáty / Fosfát (mL / min) 180227 259 185238 272 190 250 289 192 257 299 194 260 303
Vitamina B12 / Vitamine B12 / Vitamin B12 / Vitamín B12
/ Vitamín B12 (mL / min) 133 155 165142 168 179 152 183 197 160 194 212 163 199 225
Coeficiente de ultrafiltração / Ultrafiltratiecoëfficiënt
/ Ultrafiltreringskoefficient / Ultrafiltračný koeficient
/ Ultrafiltrační koeficient (mL / hr / mmHg (mL / hr / kPa)) 66 (495) 72 (540) 81 (608) 90 (675) 102 (773)
• Qb = 300 mL / min
• Sangue bovino / Runderbloed / Bovint blod / Bovínna krv
/ Hovězí krev
• Proteína total / Totaal eiwit / Totalprotein / Celkový proteín
/ Celkový protein = 60 ± 5 g/L
• Hematócrito / Hematocriet / Hematokrit / Hematokrit
/ Hematokrit = 32 ± 2 %
Queda de pressão / Drukdaling / Tryckfall / Pokles tlaku / Pokles tlaku
))aPk(gHmm(
Lado do sangue / Bloedkant / Blodsida / Krvná strana / Krevní strana 135 (18) 117 (16) 98 (13) 84 (11) 71 (9)
• Qb = 300 mL / min
• Sangue bovino / Runderbloed / Bovint blod / Bovínna krv
/ Hovězí krev
• Proteína total / Totaal eiwit / Totalprotein / Celkový proteín
/ Celkový protein = 60 ± 5 g/L
• Hematócrito / Hematocriet / Hematokrit / Hematokrit
/ Hematokrit = 32 ± 2 %
Lado do dialisado / Dialysaatkant / Dialysatsida / Dialyzačná strana
/ Dialyzátová strana
• Qd = 500 mL / min
78 (10) 73 (10) 69 (9) 66 (9) 63 (8)
Volume de preparação / Priming volume / Rengöringsvolym
)Lm(mejboícinlP/mejboicainlP/ 76 86 103 117 137
Fibras ocas / Holle vezels / Ihåliga fibrer / Duté vlákna / Dutá vlákna
Área de superfície efectiva / Effectiefoppervlak
/ Effektiv ytarea / Plocha efektívneho povrchu
/ Efektivní povrch (m2) 1.3 1.5 1.8 2.1 2.5
Diâmetro interno / Binnendiameter / Innerdiameter
/ Vnútorný priemer / Vnitřní průmě (r μm) 185
Espessura da parede / Wanddikte / Väggtjocklek
/ Hrúbka steny / Tloušťka stě (yn μm) 45
Coeficiente de peneira / Sieving coëfficiënt
/ Genomsläpplighetskoefficient / Preosievací koeficient
/ Prosívací koeficient
•Plasma bovino / Runderplasma / Bovin plasma
/ Bovínna plazma / Hovězí plazma
• Proteína total / Totaal eiwit / Totalprotein / Celkový proteín
/ Celkový protein = 60 ± 5 g/L
0.1nilunI/nílunI/nilunI/enilunI/anilunI
β2-microglobulina / β2-microglobuline / β2-mikroglobulin
/ β2-mikroglobulín / β2-mikroglobulin 0.8
Mioglobina / Myoglobine / Myoglob4.0nibolgoyM/níbolgoyM/ni
100.0nimublA/nímublA/nimublA/enimublA/animublA
ýrkoM/ýrkoM/tåV/githcoV/odimúHpyT/pyT/pyT/epyT/opiT
Limites de fluxo e pressão / Flow- en druklimieten
/ Flödes- och tryckbegränsningar / Prietokové a tlakové limity
/ Průtokové a tlakové limity
Pressão transmembranária máx. / Max. transmembraandruk
/ Max transmembrantryck / Max. transmembránový tlak
))aPk(gHmm(kaltývonárbmemsnart.xaM/ 500 (66)
Fluxo sanguíneo máx. / Max. bloedstroom
/ Max blodflöde / Max. krvný prietok / Max. průtokkrve (mL / min)500
Fluxo de dialisado máx. / Max. dialysaatstroom
/ Max dialysatflöde / Max. dialyzačný prietok
/ Max. prů)nim/Lm(utázylaidkot 800
ISO 8637:2004

18
ПРИЛОЖЕНИЕ (РУССКИЙ) EK (TÜRKÇE)
規格/型號(中文) 부록 (한국어)
Номера моделей / Model numaraları/ 型號 / 모델번호 REXEED-13A REXEED-15A REXEED-18A REXEED-21A REXEED-25A
Клиренсы / Klerence / 清除率 / 클리어런스
• Qd = 500 mL / min, Qf = 0 mL / min Qb (mL / min)200 300 400 200 300 400 200 300 400 200 300 400 200 300 400
Мочевина / Üre / 尿素 / 요소 (mL / min) 194 264 306 196 272 317 198 280 330 199 284 340199 287 350
Креатинин / Kreatinin / 肌酸酐 / 크레아티닌 (mL / min) 188 247 284 191 255 296 194 265 309 195 272 317 196 280 330
Фосфат / Fosfat / 磷酸 / 인산염 303062491992752291982052091272832581952722081)nim/Lm(
Витамин B12 / Vitamin B12 / 維生素 B12 / 비타민 B12 (mL / min) 133 155 165142 168 179 152 183 197 160 194 212 163 199 225
Коэффициентультрафильтрации
/ Ultrafiltrasyon katsayısı/ 超過濾係數 / 초여과 계수
))aPk/rh/Lm(gHmm/rh/Lm(66 (495) 72 (540) 81 (608) 90 (675) 102 (773)
• Qb = 300 mL / min
•Бычьякровь / Bovin kanı/ 牛血 / 소혈액
•Общий белок / Toplam protein / 總蛋白質
/ 총단백질량 = 60 ± 5 g/L
•Гематокрит / Hematokrit / 血球比容 / 헤마토크릿 = 32 ± 2 %
Падение давления / Basınç düşüşü / 壓力降 / 압력 저하
))aPk(gHmm(
Сторона крови / Kan tarafı / 血液端/ 혈액 측)9(17)11(48)31(89)61(711)81(531
• Qb = 300 mL / min
•Бычьякровь / Bovin kanı/ 牛血 / 소혈액
•Общий белок / Toplam protein / 總蛋白質
/ 총단백질량 = 60 ± 5 g/L
•Гематокрит / Hematokrit / 血球比容 / 헤마토크릿 = 32 ± 2 %
Сторона диализата / Diyalizat tarafı / 透析液端 / 투석액 측
• Qd = 500 mL / min
78 (10) 73 (10) 69 (9) 66 (9) 63 (8)
Объем заполнения
/ Kullanıma hazırlamak için gereken miktar
/ 預充血容量 / 충진량 (mL) 76 86 103 117 137
Половолоконный фильтр / Içi boş fiberler / 中空纖維 / 중공사
Эффективнаяплощадь волокон / Fiber etkili alan
/ 有效膜面積 / 유효표면적 (m2) 1.3 1.5 1.8 2.1 2.5
Внутренний диаметр/ Dahili çap / 內徑 / 안쪽 지름 (μ 581)m
Толщина стенки / Duvar kalınlığı / 壁厚 / 벽두께 (μ 54)m
Коэффициентфильтрования / Eleme eşdeğerlik katsayısı
/ 篩分係數 / 체계수
•Бычьяплазма / Bovin plazması/ 牛血漿 / 소혈장
•Общий белок / Toplam protein / 總蛋白質
/ 총단백질량 = 60 ± 5 g/L
Инулин / İnülin / 菊糖 / 이눌린 1.0
β2-микроглобулин / β2-mikroglobulin / β2-微球蛋白
/ β2-마이크로글로블린 0.8
Миоглобин/ Miyoglobin / 肌紅素 / 미오글로빈 0.4
Альбумин / Albümin / 蛋白素 / 알부민 0.001
Тип/ Tip / 類型 / 타입 Влажный / Nemli / 濕式 / 습식
Ограничения по потокам идавлению / Akış ve basınç sınırları
/ 流量與壓力限制/ 유량과 압력의 한계
Макс. трансмембранное давление / Maks. transmembran basınç
/ 最大膜上壓 / 최대막간압 ))aPk(gHmm(500 (66)
Макс. поток крови / Maks. kan akışı / 最大血流量
/ 최대혈류 (mL / min) 500
Макс. поток диализата / Maks. diayalizat akışı
/ 最大透析液流量/ 최대투석액 유량 (mL / min) 800
ISO 8637:2004
19
TABELA DE TRADUÇÃO (PORTUGUÊS) REFERENTIETABEL (NEDERLANDS) ÖVERSÄTTNINGSTABELL (SVENSKA)
PREKLADOVÁ TABUĽKA (SLOVENČINA) PŘEKLADOVÁ TABULKA (ČEŠTINA)
TRANSLATION TABLE (ENGLISH) TABLEAU DE TRADUCTION (FRANÇAIS) ÜBERSETZUNGSTABELLE (DEUTSCH)
TABELLA DI TRADUZIONE (ITALIANO) TABLA DE TRADUCCIONES (ESPAÑOL)
ENGLISH FRANÇAIS DEUTSCH ITALIANO ESPAÑOL
Refertoinstructions for
use Consulter les instructions
d’utilisation Gebrauchsanweisung
beachten Consultare le
istruzioni per l’uso Consulte las
instrucciones de uso
Single use only Usage unique
exclusivement Einwegartikel Dispositivo monouso Para un solo uso
Sterilized by gamma rays Stérilisé aux rayons
gamma Sterilisation durch
Gammabestrahlung Sterilizzato a raggi
gamma Esterilizado por rayos
gamma
Blood pathway is
non-pyrogenic La voie sanfuine est
apyrogène Der Blutdurchgang ist
nicht pyrogen Il compartimento ematico
è apirogeno La vía de sangre es
apirógena
Max. transmembrane
pressure
500 mmHg / 66 kPa
Pression
transmembranaire max.
500 mmHg / 66 kPa
Max.
Transmembrandruck
500 mmHg / 66 kPa
Pressione
transmembrana max.
500 mmHg / 66 kPa
Presión
transmembrana máx.
500 mmHg / 66 kPa
Store at temperatures of
0-30°C (32-86°F)
Conserver à des
températures comprises
entre 0 et 30°C (32-86°F)
Bei einer Temperatur von
0-30°C (32-86°F) lagern
Conservare a una
temperatura compresa tra
0 e 30°C (32-86°F)
Guardar a una
temperatura comprendida
entre
0 y30°C(32-86°F)
Avoid freezing Ne pas congeler Vor Frost schützen Evitare il congelamento No congelar
Use only with an
ultrafiltration control
machine
Utiliser uniquement avec
un appareil de contrôle
de l’ultrafiltration
Nur miteinem Gerät zur
Kontrolle der
Ultrafiltration verwenden
Utilizzare unicamente con
apparecchi per emodialisi
dotati di controllo UF
A utilizar sólo con una
máquina de control de
ultrafiltración
Effective surface area Surface effective de la
membrane Faserwirkfläche Area superficie effettiva Área efectiva de fibra
Blood flow Flux sanguin Blutfluss Flusso sangue Flujo sanguíneo
Dialysate flow Flux de dialyse Dialysatfluss Flusso dialisato Flujo de dializado
Lot number Numéro de lot Chargenbezeichnung Numero di lotto Número de lote
Sterilization date Date de stérilisation Sterilisationsdatum Data di sterilizzazione Fecha de esterilización
Expiration date Date d’expiration Verfallsdatum Data di scadenza Fecha de caducidad
Manufacturer Fabricant Hersteller Produttore Fabricante
European
authorized representative Représentant
européen autorisé Autorisierter
Vertreter für Europa Rappresentante
autorizzato per l’Europa Representante
autorizado en Europa
Net weight Poids net Nettogewicht Peso netto Peso neto
Made in Japan Fabriqué au Japon Hergestellt in Japan Prodotto in Giappone Hecho en Japón
PORTUGUÊS NEDERLANDS SVENSKA SLOVENČINA ČEŠTINA
Consulte as
instruções de utilização Raadpleeg instructies Läs bruksanvisningarna Pozri návod na použitie Viz pokyny pro použití
Apenas para
utilização única Eenmalig gebruik Endast för engångsbruk Len na jedno použitie Pouze k jednomu použití
Esterilizado por raios
gama Gesteriliseerd met
gammastralen Steriliserat med
gammastrålning Sterilizovaný
gama žiarením Sterilizováno gama
zářením
O percurso do sangue é
não pirogénico Het bloedcircuit is
niet-pyrogeen Blodbanan är
icke-pyrogen Krvná cesta je
nepyrogénna Cesta pro krev je
apyrogenní
Pressão
transmembranária máx.
500 mmHg / 66 kPa
Max. transmembraandruk
500 mmHg / 66 kPa Maxtransmembrantryck
500 mmHg / 66 kPa
Max. transmembránový
tlak
500 mmHg / 66 kPa
Max. transmembránový
tlak
500 mmHg / 66 kPa
Armazene a
temperaturas de 0 a 30°C
(32-86°F)
Bewaar bij een
temperatuur van 0-30°C
(32-86°F)
Förvaras vid temperaturer
kring 0-30°C (32-86°F) Skladujte pri teplotách
0-30°C (32-86°F) Uchovávejte při teplotách
0-30°C (32-86°F)
Evite congelar Niet laten bevriezen Undvik minusgrader Nevystavujte teplotám
pod bodom mrazu Nenechejte zmrznout
Utilizar apenas com uma
máquina com controlo de
ultrafiltração
Alleen gebruiken met een
ultrafiltratie
controletoestel
Bör endast användas
tillsammans med maskin
för ultrafiltreringskontroll
Používajte len s
prístrojom s reguláciou
ultrafiltrácie
Používat pouze
s ultrafiltračním
kontrolním zařízením
Área de superfície
efectiva Effectief oppervlak Effektiv ytarea Plocha efektívneho
povrchu Efektivní povrch
Fluxo sanguíneo Bloedstroom Blodflöde Tok krvi Tok krve
Fluxo do dialisado Dialysaatstroom Dialysatflöde Tok dializátu Tok dializátu
Número de lote Lotnummer Satsnummer Číslo série Číslo volby
Data de esterilização Datum sterilisatie Steriliseringsdatum Dátum sterilizácie Datum sterilizace
Data de validade Vervaldatum Utgångsdatum Dátum exspirácie Doba použitelnosti
Fabricante Fabrikant Tillverkare Výrobca Výrobce
Representante
europeia autorizada Geautoriseerde Europese
vertegenwoordiger
Auktoriserade
europeiska
representanter
Európsky
autorizovaný zástupca Autorizovaný
zástupce pro Evropu
Peso líquido Netto gewicht Nettovikt Čistá váha Čistá hmotnost
Fabricado no Japão Vervaardigd in Japan Tillverkad i Japan Vyrobené v Japonsku Vyrobeno v Japonsku

20
РУССКИЙ TÜRKÇE 中文 한국어
Обратитесь кинструкции по
эксплуатацииKullanım için
talimatlara bakın 參閱使用說明書 사용설명서를
참조하십시오
Только для однократного
применения Tek kullanımlık 限單次使用 일회용
Стерилизовано
гамма- излучениемGama ışınlarıile
sterilize edilmiştir 以γ射線滅菌 감마선에 의한 멸균
Линия крови апирогеннаяKan yolu pirojenik
olmayan 血液管路無致熱源 혈액라인은
비발열성입니다
Макс. трансмембранное
давление
500 mmHg / 66 kPa
Maks. transmembran
basınç
500 mmHg / 66 kPa
最大膜上壓
500 mmHg / 66 kPa
최대 막간압
500 mmHg / 66 kPa
Хранить при температуре
0-30°C (32-86°F) 0-30°C (32-86°F) arası
sıcaklıklarda saklayınız
請於 0-30°C(32-86°F)
保存
섭씨0-30° (화씨
32-86°) 에서 보관해
주십시오
Не замораживать Donmasınıönleyiniz 切勿冷凍 얼리지 마십시오
Использовать только с
аппаратамисконтролем
ультрафильтрации
Sadece ultrafiltrasyon
kontrol makinesiyle
kullanın
僅適用於內建超過濾控制
器的血液透析機
반드시 UF 컨트롤 기기와
함께 사용해 주십시오
Эффективная
площадь волокон Fiber etkili alan 有效膜面積 유효표면적
Ток крови Kan akışı 血液流速 혈류
Ток диализата Diyalizat akışı 透析液流速 투석액의 흐름
Номер лота Parti numarası批號 고유식별번호
Дата стерилизации Sterilizasyon tarihi 滅菌日期 살균날짜
Дата окончания срока
хранения Son kullanım tarihi 有效日期 유통기한
Производитель İmalatçı製造商 제조회사
Европейские
авторизованные
представители Yetkili Avrupa temsilcisi 歐洲授權代理商 유럽공식대리점
Масса нетто Net ağırlık 淨重 내용물 중량
ПроизведеновЯпонии Japon malı日本製 일본제
Manufacturer Fabricant Hersteller Produttore Fabricante
Fabricante Fabrikant Tillverkare Výrobca Výrobce
Производитель İmalatçı製造商 제조회사
1-105 Kanda Jinbocho, Chiyoda-ku, Tokyo 101-8101, Japan
Telephone: +81-3-3296-3727
Herriotstrasse 1, 60528 Frankfurt am Main, Germany
Telephone: +49 (0) 69 66 37 15 00
Represented in Americas by Représenté en Amériques par
Representado en Américas por Representado nas Américas por
3570 Winchester Road, Suite 101, Memphis, Tennessee 38118, USA
Telephone: +1-901-362-6105
ТАБЛИЦА ПЕРЕВОДОВ (РУССКИЙ) CEVİRİTABLOSU (TÜRKÇE)
對照表(中文) 대역표 (한국어)
B008S-1112
Table of contents
Languages:
Other ASAHI Medical Equipment manuals
Popular Medical Equipment manuals by other brands

Custo Med
Custo Med Holter ECG with custo flash 500 quick guide
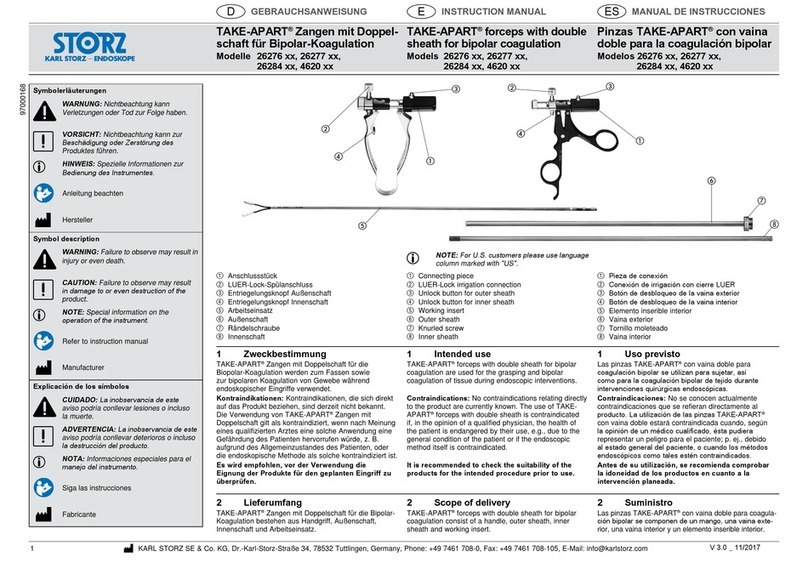
Storz
Storz 26276 Series instruction manual

aidapt
aidapt Quiet Knight Mattress Stopper Fixing and maintenance instructions

Bauerfeind
Bauerfeind uniprox DAHO 2.6 Series instruction manual

Bort
Bort 950 240 manual

Heska
Heska scil Vet abc Plus+ quick guide
Nasco
Nasco Life/form LF01167U instruction manual

Drive DeVilbiss
Drive DeVilbiss Sidhil 1006100001 user manual

Roche
Roche Accu-Chek Aviva Solo Training handbook

Pressalit Care
Pressalit Care R8122 Mounting instruction
Topcon
Topcon 3D OCT-1 Quick reference guide
Medutek
Medutek KATASPIR 230/12BR instruction manual