9
t -BTÏDVSJUÏFUMhFGGJDBDJUÏEVEJTQPTJUJGNJTFOQMBDFEBOTMBSUÒSFQPQMJUÏFOhPOUQBTÏUÏÏWBMVÏFT
t -BTÏDVSJUÏFUMhFGGJDBDJUÏEVEJTQPTJUJGVUJMJTÏFOQÏEJBUSJFOhPOUQBTÏUÏÏWBMVÏFT
t -hVUJMJTBUJPOEVEJTQPTJUJGFODPOEJUJPOEFTVQFSQPTJUJPOBWFDVOTUFOUFONÏUBMOVPVEFTFOEPQSPUIÒTFTDPVWFSUFTEhBVUSFT
GBCSJDBOUTOhBQBTÏUÏUFTUÏF
t 6OFGPSDFEFEÏQMPJFNFOUQMVTJNQPSUBOUFQFVUÐUSFOÏDFTTBJSFBWFDMFTFOEPQSPUIÒTFTDPVWFSUFTEFQMVTHSBOEFMPOHVFVS
PRÉCAUTIONS SPÉCIFIQUES LIÉES À L'ABORD AV
t -BTÏDVSJUÏFUMhFGGJDBDJUÏEVEJTQPTJUJGVUJMJTÏEBOTMFTWFJOFTDFOUSBMFTOhPOUQBTÏUÏÏWBMVÏFT
t -BTÏDVSJUÏFUMhFGGJDBDJUÏEVEJTQPTJUJGNJTFOQMBDFEBOTMBGPTTFBOUÏDVCJUBMFOhPOUQBTÏUÏÏWBMVÏFT
t -FTFGGFUTEFMBDBOVMBUJPOEJSFDUFEFMhFOEPQSPUIÒTFDPVWFSUFOhPOUQBTÏUÏÏWBMVÏT*OEJRVFSBVQBUJFOURVFMhFOEPQSPUIÒTF
DPVWFSUFOFEPJUQBTÐUSFDBOVMÏFEJSFDUFNFOUQPVSMhIÏNPEJBMZTFFURVFMhBQQMJDBUJPOEhVOFQSFTTJPOEBOTMB[POFEFMhJNQMBOU
EPJUÐUSFÏWJUÏF
COMPLICATIONS ET EFFETS INDÉSIRABLES POTENTIELS
-FTDPNQMJDBUJPOTFUMFTFGGFUT JOEÏTJSBCMFTBTTPDJÏTËMhVUJMJTBUJPOEFMhFOEPQSPUIÒTFDPVWFSUFWBTDVMBJSFCOVERA™ PLUS peuvent
OPUBNNFOUDPNQSFOESFMFTDPNQMJDBUJPOTIBCJUVFMMFTBTTPDJÏFTËMBNJTFFOQMBDFEFTUFOUTFOEPWBTDVMBJSFTFUEhFOEPQSPUIÒTFT
DPVWFSUFTBJOTJRVhBVYSÏWJTJPOTEFTIVOUEhBCPSEEFEJBMZTF
Les complications potentielles pouvant se produire sont les suivantes (liste non exhaustive) :
BCDÒTJOGFDUJPOBVTJUFEhBCPSESÏBDUJPOBMMFSHJRVFBOBQIZMBDUPÕEFBNQVUBUJPOBOÏWSJTNFBOHJOFJTDIÏNJFDPSPOBJSFGJTUVMF
BSUÏSJPWFJOFVTFBSZUINJFTBJHOFNFOUBVTJUFEhBCPSEQPOUBHFBDDJEFOUWBTDVMBJSFDÏSÏCSBMJOTVGGJTBODFDBSEJBRVFDPOHFTUJWF
FNCPMJTBUJPO FYUSBWBTBUJPO GJÒWSF IÏNBUPNF IÏNPSSBHJF IÏNPQUZTJF IZQPUFOTJPOIZQFSUFOTJPO MÏTJPOEJTTFDUJPO EF
MJOUJNB JTDIÏNJFJOGBSDUVT EF UJTTVEhPSHBOF JOGFDUJPO JOGBSDUVT EV NZPDBSEF PDDMVTJPO EPVMFVST FNCPMJF QVMNPOBJSF
QFSGPSBUJPOTBJHOFNFOUQSPMPOHÏQTFVEPBOÏWSJTNFVSUJDBJSFSÏBDUJPOBVQSPEVJUEFDPOUSBTUFJOTVGGJTBODFSÏOBMFUPYJDJUÏ
SÏOBMFSBEJPMÏTJPOSFTUÏOPTFTFQUJDÏNJFCBDUÏSJÏNJFTFQTJT"7$UISPNCVTWBTPTQBTNFGJCSJMMBUJPOWFOUSJDVMBJSFSVQUVSFEFT
WBJTTFBVYFUEÏDÒT
Les effets indésirables spécifiques à l'abord AV peuvent inclure, sans s'y limiter :
EÒNFEVCSBTPVEFMBNBJOTZOESPNFEFEÏUPVSOFNFOUFUEÒNFEFMBGBDFPVEVDPV
Les événements spécifiques à l'endoprothèse couverte pouvant être associés aux complications cliniques sont
(liste non exhaustive) :
FNCPMJFGSBDUVSFFYQBOTJPOJOTVGGJTBOUFEF MhFOEPQSPUIÒTFDPVWFSUFQMJBHFNJTFFOQMBDF FSSPOÏFNJHSBUJPOEÏQMBDFNFOU
FUPDDMVTJPOEFMBCSBODIFMBUÏSBMF
Les événements spécifiques au système de mise en place pouvant être associés aux complications cliniques sont,
sans s'y limiter :
GVJUF EF TBOH QBS MF TZTUÒNF EF NJTF FO QMBDF EÏGBJMMBODF EFT BTTFNCMBHFT DPMMÏT QMJBHF EV TZTUÒNF EF NJTF FO QMBDF
EÏUBDIFNFOUEFQBSUJFTEÏGBVUEFEÏQMPJFNFOUGPSDFTEFEÏQMPJFNFOUJNQPSUBOUFTJNQPTTJCJMJUÏEFTVJWJKVTRVhËMhFNQMBDFNFOU
DJCMFEÏQMPJFNFOUJNQSÏDJTJODPNQBUJCJMJUÏBWFDMFTBDDFTTPJSFTBCTFODFEFWJTJCJMJUÏTPVTSBEJPTDPQJFFUEÏQMPJFNFOUQSÏNBUVSÏ
SÉLECTION DE LA TAILLE DE L'ENDOPROTHÈSE COUVERTE
6OTPJOQBSUJDVMJFSEPJUÐUSFBQQPSUÏËMBTÏMFDUJPOEhVOEJTQPTJUJGEFUBJMMFBQQSPQSJÏF&ODBTEFEJGGÏSFODFEFEJBNÒUSFFOUSF
MhFYUSÏNJUÏFOUSBOUFFUTPSUBOUFUPVKPVSTVUJMJTFSMFEJBNÒUSFEVWBJTTFBVFOUSBOUPVEVHSFGGPO"7DPNNFEJBNÒUSFEFWBJTTFBV
EFSÏGÏSFODF
Tableau 1 : Sélection du diamètre de l'endoprothèse couverte
Diamètre de l'endoprothèse
couverte
Surdimensionnement
recommandé Diamètre du vaisseau de référence
6 mm 0,5 mm – 1,5 mm 4,5 mm – 5,5 mm
7 mm 0,5 mm – 1,5 mm 5,5 mm – 6,5 mm
8 mm 1 mm – 2 mm 6 mm – 7 mm
9 mm 1 mm – 2 mm 7 mm – 8 mm
10 mm 1 mm – 2 mm 8 mm – 9 mm
-B SÏVUJMJTBUJPO EF DF EJTQPTJUJG NÏEJDBM DPNQPSUF VO SJTRVF EF DPOUBNJOBUJPO EhVO QBUJFOU Ë MhBVUSF ÏUBOU EPOOÏ RVF
MFTEJTQPTJUJGTNÏEJDBVYTVSUPVU DFVY ÏRVJQÏT EF MVNJÒSFT MPOHVFT FU GJOFTEhBSUJDVMBUJPOT FUPV EhJOUFSTUJDFTFOUSFMFT
DPNQPTBOUTTPOU EJGGJDJMFT WPJSF JNQPTTJCMFT Ë OFUUPZFS VOF GPJT RVF EFT MJRVJEFT PV UJTTVT DPSQPSFMT ÏWFOUVFMMFNFOU
BGGFDUÏTEhVOFDPOUBNJOBUJPOQZSPHÒOFPVNJDSPCJFOOFTPOUFOUSÏTFODPOUBDUBWFDMFEJTQPTJUJGNÏEJDBMQFOEBOUVOFEVSÏF
JOEÏUFSNJOÏF-FTSÏTJEVTEFNBUÏSJBVYCJPMPHJRVFTQFVWFOUQSPNPVWPJSMBDPOUBNJOBUJPOEVEJTQPTJUJGQBSEFTQZSPHÒOFTPV
EFTNJDSPPSHBOJTNFTQPVWBOUFOUSBÔOFSEFTDPNQMJDBUJPOTJOGFDUJFVTFTPVÐUSFËMhPSJHJOFEhVOEÏDÒT
t NE PASVUJMJTFSDIF[MFTQBUJFOUTQSÏTFOUBOUEFTUSPVCMFTEFMBDPBHVMBUJPOJSSÏNÏEJBCMFT
t NE PASVUJMJTFSDIF[MFTQBUJFOUTOFQPVWBOUSFDFWPJSVOFQSÏNÏEJDBUJPOBEÏRVBUF
t NE PASVUJMJTFSDIF[MFTQBUJFOUTQSÏTFOUBOUVOFBMMFSHJFPVVOFTFOTJCJMJUÏDPOOVFBVYQSPEVJUTEFDPOUSBTUF
t NE PASVUJMJTFSDIF[MFTQBUJFOUTQSÏTFOUBOUVOFIZQFSTFOTJCJMJUÏDPOOVFBVOJDLFMUJUBOFPVBVUBOUBMF
t NE PAS VUJMJTFS MF EJTQPTJUJG DIF[ MFT QBUJFOUT QPVS MFTRVFMT MhFYQBOTJPO UPUBMF EhVO DBUIÏUFS Ë CBMMPOOFU 15" EF UBJMMF
BQQSPQSJÏFOhBQBTQVÐUSFPCUFOVFQFOEBOUMBQSÏEJMBUBUJPOBWFDVOCBMMPOOFUEhBOHJPQMBTUJF
t NE PASVUJMJTFSDIF[MFTQBUJFOUTOFQPVWBOUQBTCÏOÏGJDJFSEVUSBJUFNFOUBOUJQMBRVFUUBJSFFUPVBOUJDPBHVMBOUSFDPNNBOEÏ
t NE PASVUJMJTFSDIF[MFTQBUJFOUTQSÏTFOUBOUVOFPCTUSVDUJPOBSUÏSJFMMFGPODUJPOOFMMFNFOUQFSUJOFOUFEFMBWPJFEhBGGMVYVO
NBVWBJTEÏCJUPVVOFBCTFODFEhÏDPVMFNFOUEJTUBM
t NE PASNFUUSFFOQMBDFDIF[MFTQBUJFOUTQSÏTFOUBOUVOFMÏTJPODJCMFBDDPNQBHOÏFEhVOUISPNCVTBJHVPVTVCBJHVJNQPSUBOU
ËQSPYJNJUÏ
t -BNJTFFOQMBDFEhVOFFOEPQSPUIÒTFDPVWFSUFTVSMBCSBODIFMBUÏSBMFEhVOWBJTTFBVQFVUFNQÐDIFSMBDJSDVMBUJPOTBOHVJOFFU
FOUSBWFSPVFNQÐDIFSEFTQSPDÏEVSFTGVUVSFT
t NE PASVUJMJTFSQPVSMFUSBJUFNFOUEFTMÏTJPOTQPVWBOUFNQÐDIFSVOQPOUBHFEFTBVWFUBHF
t NE PAS TVJWSFFUEÏQMPZFSMFTZTUÒNFFOEPWBTDVMBJSF'EBOTMBCJGVSDBUJPOBPSUPJMJBRVFEFNBOJÒSFDSPJTÏFDBSDFMBQFVU
FOUSBÔOFSVOEÏGBVUEFEÏQMPJFNFOUEFMhFOEPQSPUIÒTFDPVWFSUF
t -FTFGGFUTËMPOHUFSNFEFMBEJMBUBUJPOËSÏQÏUJUJPOEFTFOEPQSPUIÒTFTDPVWFSUFTFOEPUIÏMJBMJTÏFTOFTPOUQBTDPOOVT
AVERTISSEMENTS SPÉCIFIQUES LIÉS À L'ABORD AV
t -FTVJWJFUMFEÏQMPJFNFOUEVEJTQPTJUJGBVUPVSEhVOHSFGGPO"7FOCPVDMFOhPOUQBTÏUÏUFTUÏT
t NE PASVUJMJTFSDIF[MFTQBUJFOUTEPOUMFTHSFGGPOTEhBCPSE"7POUÏUÏJNQMBOUÏTJMZBNPJOTEFKPVSTPVEBOTVOFGJTUVMFJNNBUVSF
t -BNJTFFOQMBDFEhVOFFOEPQSPUIÒTFDPVWFSUFBVEFMËEFMhPTUJVNEFMBWFJOFDÏQIBMJRVFEBOTMBWFJOFBYJMMBJSFTPVTDMBWJÒSF
QFVUFOUSBWFSPVFNQÐDIFSVOBCPSEVMUÏSJFVS
t NE PASVUJMJTFSDIF[MFTQBUJFOUTQSÏTFOUBOUVOFCBDUÏSJÏNJFPVVOFTFQUJDÏNJFFUPVEFTQSFVWFTEhJOGFDUJPOEFMBGJTUVMF
ou du greffon.
PRÉCAUTIONS
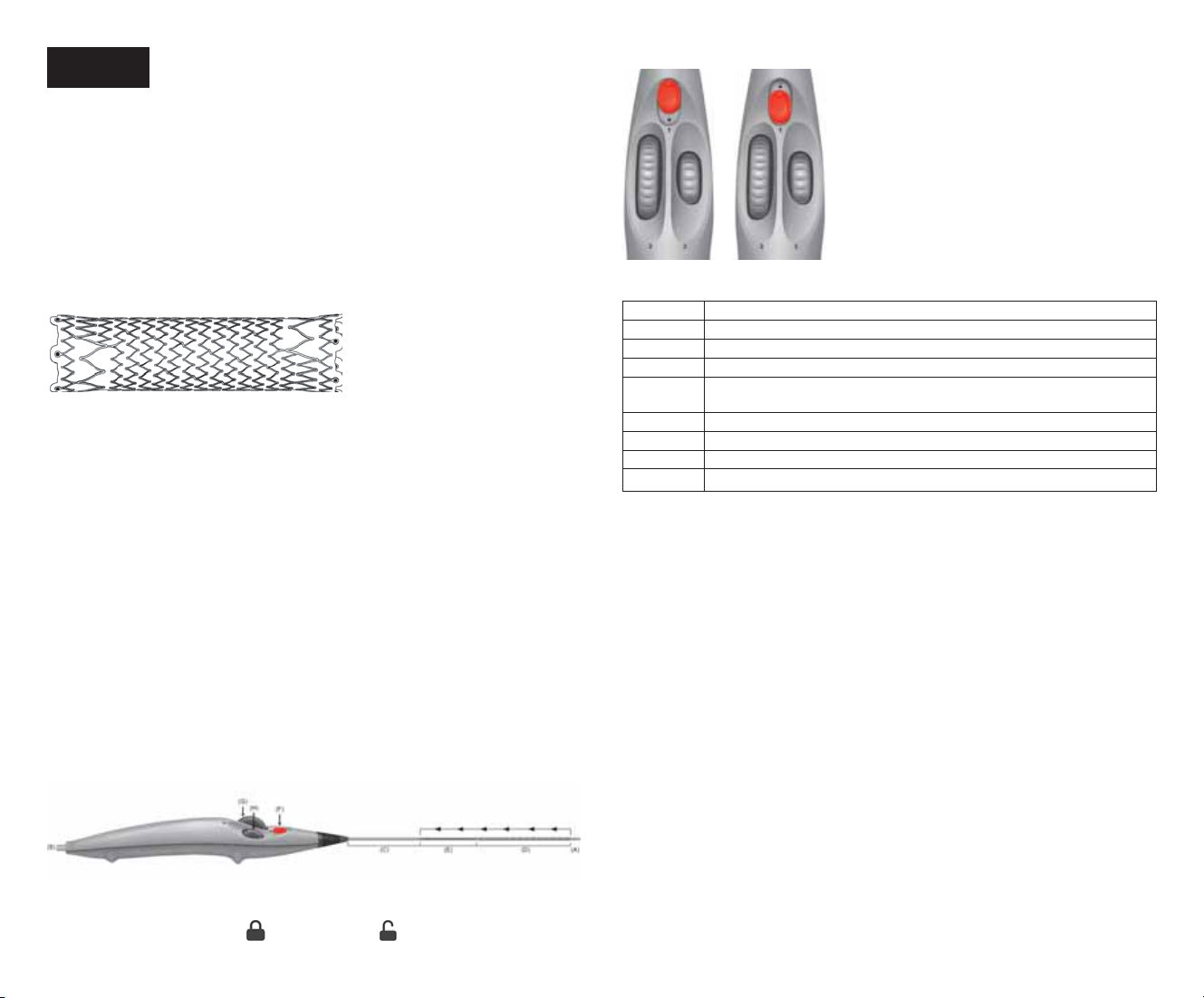
t "WBOUEhJNQMBOUFSMhFOEPQSPUIÒTFDPVWFSUFTFSFQPSUFSBVUBCMFBVEFEJNFOTJPOOFNFOU5BCMFBVFUMJSFMFNPEFEhFNQMPJ
t -FTZTUÒNFEFNJTFFOQMBDFFTUEFTUJOÏVOJRVFNFOUBVEÏQMPJFNFOUEFMhFOEPQSPUIÒTFDPVWFSUF
t -PSTEFMBNJTFFOQMBDFEVEJTQPTJUJGTFMPOVOFUFDIOJRVFDSPJTÏFNBJOUFOJSMhFYUSÏNJUÏQSPYJNBMFEFMhFOEPQSPUIÒTFDPVWFSUF
FOQPTJUJPOESPJUFQFOEBOUUPVUFMBQSPDÏEVSFEFEÏQMPJFNFOU
t -hFOEPQSPUIÒTFDPVWFSUFJNQMBOUOFQFVUQBTÐUSFSFQPTJUJPOOÏFPVSÏDVQÏSÏFBQSÒTVOEÏQMPJFNFOUUPUBMPVQBSUJFM
t "QSÒTEÏQMPJFNFOUQBSUJFMPVDPNQMFUMhFOEPQSPUIÒTFDPVWFSUFOFQFVUQBTÐUSFSÏUSBDUÏFPVSFNPOUÏFTVSMFTZTUÒNFEFNJTF
en place.
t &ODBTEFSÏTJTUBODFJOIBCJUVFMMFQFOEBOUMhJOUSPEVDUJPOEVTZTUÒNFEhFOEPQSPUIÒTFDPVWFSUFSFUJSFSMFTZTUÒNFFUFOVUJMJTFS
un autre.
t NE PASJOUSPEVJSFPVNBOJQVMFSMFTZTUÒNFEFNJTFFOQMBDFTBOTVOGJMHVJEFEFUBJMMFBQQSPQSJÏFFUTBOTHVJEBHFSBEJPTDPQJRVF
t NE PASVUJMJTFSVOTZTUÒNFEFNJTFFOQMBDFQMJÏ
t 1PVSMFTJOUFSWFOUJPOTDPOUSPMBUÏSBMFTVOFMPOHVFHBJOFEhJOUSPEVDUJPODSPJTÏFPVVODBUIÏUFSEFHVJEBHFEPJUÐUSFNJTFO
QMBDFTVSMBCJGVSDBUJPOBPSUPJMJBRVF4hBTTVSFSRVFMhFYUSÏNJUÏQSPYJNBMFEFMhFOEPQSPUIÒTFDPVWFSUFFTUQPTJUJPOOÏFEBOT
VOFTFDUJPOESPJUFEVWBJTTFBVQFOEBOUMFEÏQMPJFNFOU
t 1FOEBOUMBMJCÏSBUJPOEFMhFOEPQSPUIÒTFDPVWFSUF NE PASUFOJSMFTFHNFOUEFDBUIÏUFSEJTUBMMPOHEFDNDBSJMEPJUQPVWPJS
bouger et coulisser librement dans la gaine de stabilisation blanche.
t -F DIJSVSHJFO EPJU GBJSF QSFVWF EhVOF BUUFOUJPO QBSUJDVMJÒSF MPST EV EÏQMPJFNFOU EF MhFOEPQSPUIÒTF DPVWFSUF QPVS EJNJOVFS
MhÏWFOUVBMJUÏEhVOFNJHSBUJPOEJTUBMFEFDFUUFEFSOJÒSF
t -hFOEPQSPUIÒTFDPVWFSUFOFQFVUQBTÐUSFQPTUEJMBUÏFBVEFMËEFTPOEJBNÒUSFJOEJRVÏTVSMhÏUJRVFUUF
t -BTÏDVSJUÏFUMhFGGJDBDJUÏEVEJTQPTJUJGQMBDÏTVSVOBOÏWSJTNFPVVOQTFVEPBOÏWSJTNFOhPOUQBTÏUÏÏWBMVÏFT
t -BTÏDVSJUÏFUMhFGGJDBDJUÏEVEJTQPTJUJGQMBDÏTVSVOTUFOUFONÏUBMOVQSÏDÏEFNNFOUNJTFOQMBDFOhPOUQBTÏUÏÏWBMVÏFT