Küvetten unbeschädigt sind. Ist ein Beutel beschädigt, dürfen die enthaltenen Küvetten
nicht mehr verwendet werden. Darüber hinaus sollten Sie vor der Verwendung einer
einzelnen Küvette stets sicherstellen, dass die Folienverpackung intakt ist.
● Die klare Oberäche im unteren Teil der Küvette nicht berühren (optischer Teil). Küvetten
mit Fingerabdrücken verwerfen.
● QuikRead CRP Reagenzstopfen sind zur Unterscheidung von anderen QuikRead
Analyten farbkodiert blau.
● Die QuikRead CRP Reagenzstopfen vor Feuchtigkeit schützen. Die Aluminiumröhrchen
sofort nach Entnahme der erforderlichen Anzahl an Reagenzstopfen verschließen.
● Darauf achten, dass keine Flüssigkeiten in das Küvettenfach des Instruments gelangen.
6Probennahme und Probenvorbereitung
Probennahme, Aufbereitung und Lagerung
Probe Proben-
volumen Probennahme
Vollblut
aus der Finger-
kuppe
20 μl
Mit der Lanzette in die Fingerkuppe stechen und den ersten
Tropfen verwerfen. Den Finger abwischen und das Blut in der
Glaskapillare bis zur 20 μl Marke aufsteigen lassen.
Vollblut
mit Anti-
koagulantien
20 μl
EDTA versetztes Vollblut kann verwendet werden.
Das Vollblut durch mehrmaliges Kippen des Röhrchens mischen
und 20 µl mit Kapillarröhrchen oder Pipette entnehmen.
Plasma
20 μl
oder
12 μl *
EDTA oder Heparin versetztes Vollblut kann verwendet werden.
Hämolysierte Proben vermeiden. Geringe
Hämolyse hat keinen Einuss auf das Testergebnis.
Serum
20 μl
oder
12 μl *
Hämolysierte Proben vermeiden. Geringe Hämolyse hat keinen
Einuss auf das Testergebnis.
*Wenn Sie ein Probenvolumen von 12 μl nutzen wollen, um einen breiteren Messbereich zu
haben, müssen die Einstellungen des QuikRead go Instruments geändert werden.
Siehe Bedienungsanleitung: Einstellungen → Messablauf → Testparameter.
Probenverdünnung
Vollblut Vollblutproben nicht verdünnen.
Plasma/
Serum
Plasma- oder Serumproben können mit 0,9% NaCl Lösung verdünnt werden,
bevor die Probe in die Küvette gegeben wird. Das Verdünnungsverhältnis ist
1+3 (ein Teil des Probenvolumens und 3 Teile 0,9% NaCl). Entnehmen Sie
20µl der verdünnten Probe in eine Küvette, dann messen Sie und multiplizie-
ren das Ergebnis mit 4.
Probenlagerung
Probe Kurzzeit-Lagerung Langzeit-Lagerung
Kapillarblut Nicht mehr als 15 Minuten
in der heparinisierten Kapillare Nicht lagern
Vollblut mit
Antikoagulantien 2...8°C 3 Tage Plasma abtrennen,
mindestens –20°C
Plasma 2...8°C 7 Tage mindestens –20°C
Serum 2...8°C 7 Tage mindestens –20°C
Probe (Vollblut, Plasma,
Serum) in Pufferlösung. 18…25°C für 2 Stunden Nicht lagern.
Alle Proben vor der Testdurchführung auf Raumtemperatur bringen (18...25ºC). Gefrorene
Proben komplett auftauen, gut mischen, auf Raumtemperatur bringen. Wenn die aufgetaute
Probe Klumpen enthält, Probe zentrifugieren. Proben nicht wiederholt einfrieren und auftauen.
7 Testverfahren
Zusätzlich benötigtes Material
Material Kat. Nr.
QuikRead go®Instrument
Kapillaren (20 μl) 50 Stck
Stifte 50 Stck
QuikRead CRP Kontrolllösung
QuikRead go CRP Kontrolllösung High
Lanzetten für die Vollblutanalyse
133893
67962
67966
68296
137071
Mitgeliefert bei 135171
Mitgeliefert bei 135171
Erforderlich für die Qualitätskontrolle
Erforderlich für die Qualitätskontrolle
Testdurchführung
Den Folienbeutel des Küvettenständers entsorgen und das Öffnungsdatum auf dem Küvetten-
ständer notieren.
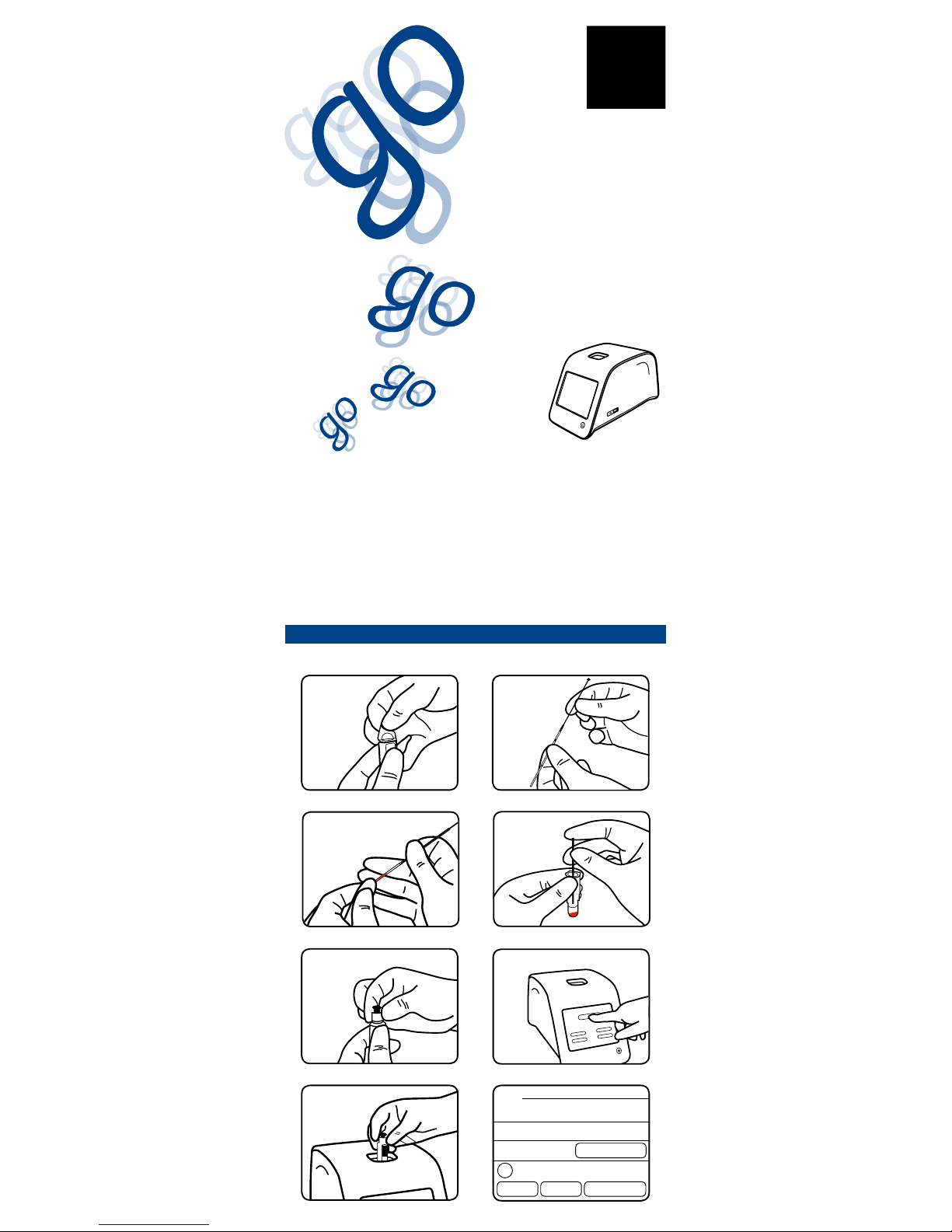
Probensammlung (Fig. 1–5)
Zur Probenbeigabe in die vorgefüllte Küvette werden Glaskapillaren (20 μl) und Stifte
empfohlen. Kapillaren (Kat. Nr. 67962) und Stifte (Kat. Nr. 67966) können getrennt bezogen
werden, im QuikRead go CRP Kit (Kat. Nr. 135171) sind sie bereits enthalten.
1Alle Reagenzien sollten bei Gebrauch Raumtemperatur (18...25ºC) haben. Eine gekühlte
Küvette (2...8ºC) erreicht nach 15 Minuten Raumtemperatur. Die klare Oberäche im
unteren Teil der Küvette nicht berühren (optischer Teil). Entfernen Sie den Folienverschluss
der Küvette. Vorsicht: keine Pufferlösung verschütten. Kondensierte Pufferlösung auf dem
Folienverschluss hat keinerlei Einuss auf das Ergebnis. Der Test muss innerhalb von 2
Stunden nach Öffnen der Küvette erfolgen. Die Flüssigkeitsoberäche muss zwischen
den beiden Markierungslinien der Küvette sein.
2Stift in das Kapillarende mit dem blauen Streifen einsetzen.
3 Kapillare bis zum weissen Stöpsel füllen. Sicherstellen, dass keine Luftblasen in der
Kapillare sind. Weiches Tuch benutzen, um überüssige Probe von der Außenseite der
Kapillare zu entfernen.
4Stecken Sie die Probenkapillare in die Pufferlösung in der Küvette und entleeren Sie sie
durch Herunterdrücken des Stifts. Die Kapillare muss vollständig geleert werden.
5Die Küvette sorgfältig mit dem CRP Reagenzstopfen verschließen. Den blauen inneren
Teil des Reagenzstopfens noch nicht herunterdrücken. Nachdem die Probe zum Puffer
gegeben wurde, kann sie bis zu zwei (2) Stunden vor Durchführung des Tests gelagert
werden. Die Küvette aufrecht halten und nicht schütteln.
Probenanalyse (Fig. 6–8)
Siehe Bedienungsanleitung des QuikRead go Instruments für genaue Vorgehensweise. Die
Anzeige führt Sie durch den Testverlauf.
6Wählen Sie Messen auf der Anzeige des QuikRead go Instruments.
7Setzen Sie die Küvette in das Küvettenfach des Instruments. Der Strichcode muss zu
Ihnen zeigen, wie in Bild 7 dargestellt. Das Instrument erkennt den Typ der Probe. Die
Anzeige zeigt, wie die Messung verläuft. Zuerst misst das Instrument die Blindprobe.
Danach misst das Instrument die CRP Konzentration innerhalb einer Minute.
8 Nach Abschluss der Messung wird das Ergebnis auf der Anzeige dargestellt und die
Küvette fährt automatisch aus dem Küvettenfach.
Kontrollprobenanalyse (Fig. 7–8)
Bitte die Bedienungsanleitung für jede Kontrollsubstanz einsehen. Führen Sie die
Kontrollprobenanalyse wie andere Messungen durch, aber wählen Sie Qualitäts-
kontrolle auf der Anzeige des QuikRead go Instruments (Fig. 7–8). Das Ergebnis
wird dann als Kontrollmessung gespeichert.