7
DE
Gefahrenhinweise für Komponenten gemäß den anwendbaren Richtlinien
der Europäischen Gemeinschaft (EG):
R25, S1/2-45-60
Giftig: Enthält Natriumnitrit.
R25 Giftig beim Verschlucken.
S1/2-45-60 Unter Verschluss und für Kinder unzugänglich aufbewahren. Bei
Unfall oder Unwohlsein sofort Arzt zuziehen (wenn möglich, dieses Etikett
vorzeigen). Dieses Produkt und sein Behälter sind als gefährlicher Abfall zu
entsorgen.
R22, S2-35-46
Gesundheitsschädlich: Enthält Natriumazid
R22 Gesundheitsschädlich beim Verschlucken.
S2-35-46 Darf nicht in die Hände von Kindern gelangen. Abfälle und Behälter
müssen in gesicherter Weise beseitigt werden. Bei Verschlucken sofort
ärztlichen Rat einholen und Verpackung oder Etikett vorzeigen.
Das Sicherheitsdatenblatt ist für professionelle Fachkräfte auf Anforderung
erhältlich.
PROBENENTNAHME & -LAGERUNG
Proben müssen durch Standard-Rachenabstrich Methoden5,6 genommen
werden. Ausschließlich polyesterummantelte (Dacron) Abstrichtupfer
verwenden. Keine Calciumalginat-Abstrichtupfer, halbfeste Transportmedien
oder Medien mit Aktivkohle verwenden.
Falls Abstrichtupfer nicht sofort verarbeitet werden, können sie in einem
sauberen, trockenen, verschließbaren Plastikröhrchen gekühlt (2-8°C) bis zu
72 Stunden vor dem Testen gelagert werden.
VERFAHREN
Falls Reagenzien, Testkassetten oder Patientenproben gekühlt gelagert
werden, müssen sich diese vor dem Test für mindestens 30 Minuten an die
Raumtemperatur (18-30°C) anpassen können. Die Folientaschen dürfen erst
geöffnet werden, wenn der Test durchgeführt wird.
Extraktion
Alle Tropfen müssen frei fallen, wobei die Reagenzaschen vertikal gehalten
werden müssen.
1. 3 Tropfen des Reagenz 1 in das Extraktionsröhrchen geben. Die Lösung
muss rosa sein.
2. 3 Tropfen des Reagenz 2 in das gleiche Röhrchen hinzugeben. Die Lösung
muss sich gelb färben.
3. Probentupfer in das Röhrchen geben. Den Tupfer drehen und Probe gut
vermischen. Die Probe für mindestens 1 Minute ruhen lassen, aber nicht
länger als 30 Minuten.
4. 3 Tropfen des Reagenz 3 in das gleiche Röhrchen hinzugeben. Den Tupfer
drehen und Probe gut vermischen. Die Lösung muss sich rosa färben. Unter
Umständen kann es erforderlich sein, einen vierten Tropfen des Reagenz 3
hinzuzufügen, um den Farbwechsel zu erzielen.
5. Flüssigkeit gründlich aus dem Tupfer drücken, indem das Röhrchen
zwischen Daumen und Zeigenger zusammendrücken wird,
anschließend den Tupfer beim Herausziehen drehen.
6. Tupfer ordnungsgemäß entsorgen.
7. Tropfkappe auf das Extraktionsröhrchen setzen.
Gekühlt (2-8°C) ist das Extrakt in einem geschlossenen Röhrchen bis zu
72 Stunden stabil.
Testverfahren
Die Testkassette aus ihrer Folientasche entnehmen. Mit der Patienten- oder
Kontrollkennzeichnung beschriften. Auf einer sauberen, achen, trockenen
Oberäche ablegen.
8. Den gesamten Inhalt des Extraktionsröhrchens tropfenweise in das
Probenauftragsfeld der Testkassette geben.
9. Abwarten, bis sich eine rosa/rote Färbung am Ende des Assay-Fensters
zeigt (nach ungefähr 5 Minuten). Ergebnis ablesen. Ergebnisse nicht später
als 10 Minuten nach dem Hinzufügen des Extrakts interpretieren.
HINWEIS: Um das AlereTM TestPack Strep A als Test zur Verizierung einer
Kultur zu verwenden, eine isolierte beta-hämolytische Kolonie mit einem
sauberen polyesterummantelte (Dacron) Abstrichtupfer vom Kulturträger
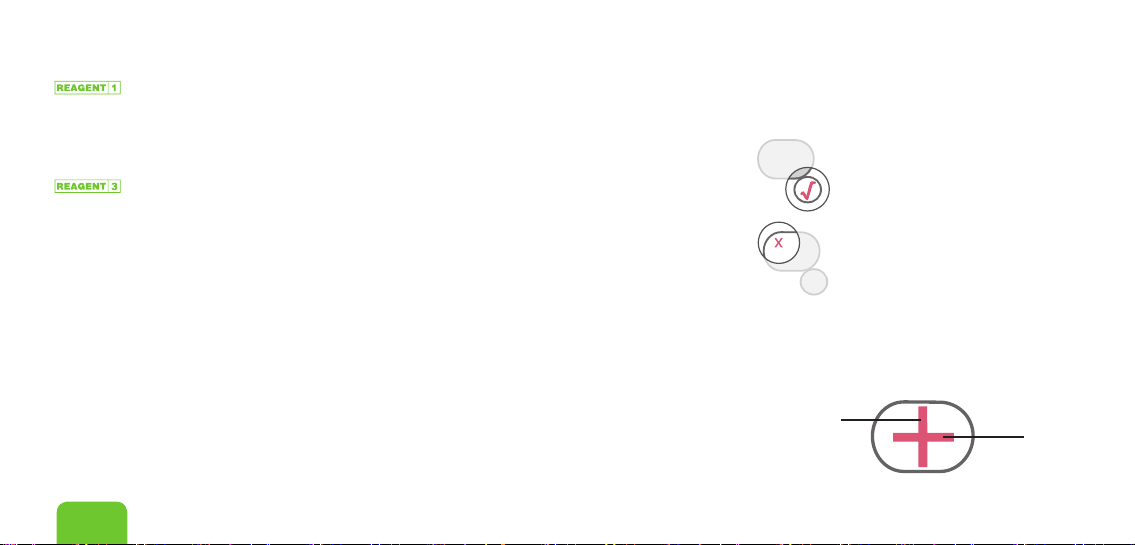
• Dieinterne Positiv-Kontrolle (POS CTL “√”) zeigt an,
dass sowohl der Antikörper-Kolloidkomplex als auch die
Systeme zur Erfassung der Antikörper funktionsfähig sind.
Für ein gültiges Ergebnis muss POS CTL “√” erscheinen.
• Dieinterne Negativ-Kontrolle (NEG CTL “X”) zeigt an,
dass die Testprobe eine unspezische Substanz enthält,
die zu einem falschen positiven Ergebnis führen kann.
Falls NEG CTL “X” im Ergebnisfenster angezeigt wird, ist
das Testergebnis ungültig.
• DasMinus-Zeichen “-” zeigt an, dass eine Migration des Extrakts aufgetreten
ist. Für ein gültiges Testergebnis muss das Minus-Zeichen “–“ erscheinen.
• DasEnde des Assay-Fensters muss zu einer roten/pinken Färbung
wechseln, wodurch angezeigt wird, dass der Test abgeschlossen und bereit
für die Ablesung ist. Für ein gültiges Testergebnis muss der Farbwechsel
am Ende des Assay-Fensters erscheinen. Ergebnisse nicht später als
10 Minuten nach dem Hinzufügen des Extrakts interpretieren.
entnehmen und damit das oben beschriebene Testverfahren vollständig
durchführen.
TESTAUSWERTUNG
Integrierte Kontrollen
AlereTM TestPack Strep A verwendet fünf integrierte Kontroll-Mechanismen,
um sicherzustellen, dass der Test ordnungsgemäß funktioniert.
• DieExtraktionsreagenzkontrolle zeigt während des Verfahrens der
Abstrichextraktion durch Farbwechsel an, dass Reagenz 1, 2 und 3 in der
richtigen Reihenfolge hinzugefügt wurden. Reagenz 1 ist pink, wechselt
aber seine Farbe zu gelb, wenn Reagenz 2 hinzugefügt wird. Nach dem
Hinzufügen von Reagenz 3 wechselt die Lösung ihre Farbe von gelb zurück
zu pink. Falls einer der Farbwechsel nicht auftritt, ist der Test ungültig.
TP Strep A ROW 240599R4_5.indd 7 2011/08/12 12:00:31