BioStable HAART 200 User manual

DWG-01-023 Rev. C - ©2021 1
Instructions for Use - HAART 200 Aortic Annuloplasty Device
Instructions for Use - HAART 200 Aortic Annuloplasty Device ....................................................................2
Инструкции за употреба – изделие за аортна анулопластика HAART 200 ....................................8
Návod k použití - Zařízení k aortální anuloplastice HAART 200 ................................................................15
Brugsanvisning - HAART 200 aortisk annuloplastikanordning....................................................................21
Instructies voor gebruik - HAART 200-aorta-annuloplastiekimplantaat.......................................................27
Käyttöohje - HAART 200 -aortta-annuloplastiarengas ................................................................................34
Mode d’emploi - Dispositif d’annuloplastie aortique HAART 200 ................................................................40
Gebrauchsanweisung - Aortenanuloplastie-Implantat HAART 200.............................................................47
Οδηγίες χρήσης - Συσκευή αορτικής δακτυλιοπλαστικής HAART 200
..................................................54
Istruzioni per l’uso del dispositivo per anuloplastica aortica HAART 200....................................................62
Bruksanvisning - HAART 200 aortisk annuloplastikkenhet .........................................................................69
Instrukcja użytkowania - Urządzenie do annuloplastyki aortalnej HAART 200 ...........................................75
Instrucţiuni de utilizare – Dispozitiv de anuloplastie aortică HAART 200 .............................................82
Navodila za uporabo – naprava za anuloplastiko aortne zaklopke HAART 200 ........................................89
Instrucciones de uso -Dispositivo de anuloplastia aórtica HAART 200.......................................................95
Bruksanvisning -HAART 200 aortaannuloplastikenhet .............................................................................102

DWG-01-023 Rev. C - ©2021 2
Instructions for Use -
HAART 200 Aortic Annuloplasty Device
Do not re-use
Use by date
MR Conditional
Sterilized using irradiation
Consult Instructions for Use
Product complies with requirements of directive 93/42/EEC for
medical devices
Do not resterilize
1. Device Labeling Symbols
Manufacturer
Keep dry
Authorized European Rep
Batch code Catalog number
Do not use if package is damaged
MD
2. Intended Use
The HAART 200 Aortic Annuloplasty Device is intended to be used to
correct annular dilatation and/or maintain annular geometry of the aortic
valve in adult patients undergoing bicuspid aortic valve repair.
3. Indications for Use
The HAART 200 Aortic Annuloplasty Device is indicated in adult patients
undergoing bicuspid aortic valve repair for aortic insufficiency or con-
comitant to repair of an aortic aneurysm.
4. Annuloplasty Device Description
4.1. Overview
The HAART 200 Aortic Annuloplasty Device is a three dimensional
annuloplasty ring designed to correct annular dilatation and/or maintain
annular geometry of the aortic valve in adult patients undergoing bicus-
pid aortic valve repair. The Device consists of a titanium frame machined
from medical grade Titanium 6Al-4V covered with medical grade polyes-
ter fabric affixed to the frame by suture.
4.2. Technological Characteristics
The HAART 200 Aortic Annuloplasty Device is comprised of three com-
ponents: the implantable Annuloplasty Device, polyester Pledgets, and
a Device Holder that is discarded during the procedure. Each of these
components is briefly described below.
Annuloplasty Device
The HAART 200 Aortic Annuloplasty Device has a circular base geom-
etry with two 10°, outwardly flaring, subcommissural posts positioned at
180° around the circumference of the device. The annuloplasty device
consists of a titanium frame machined from medical grade Titanium 6Al-
4V covered with medical grade polyester fabric affixed to the frame by
suture. The Device materials and the manufacturing processes were
specifically selected for use in an implantable medical device. The poly-
ester fabric, ARF001, is manufactured for annuloplasty ring applications.
HAART 200 Aortic Annuloplasty Devices are manufactured in 4 sizes
ranging from 19mm to 25mm in 2mm increments.
The titanium frame of the Device provides the stiffness to reduce the
diameter of the dilated aortic annulus while the polyester fabric provides
material to support endothelialization and direct suturing of the sub-
commissural posts to the aortic valve annulus. The inner aspects of the
Device posts have 2 layers of polyester fabric to facilitate suturing.
Polyester Pledgets
Polyester Pledgets are 7mm by 3mm and are made from the same
ARF001 fabric used to cover the Device. The Pledgets are provided with
the annuloplasty Device for use during surgery. They are supplied sterile
in a separate package within the Device shelf box. Individual packages
of 6 sterile pledgets are also available in the HAART Polyester Pledget
6-Pack.
Holder
The HAART 200 Aortic Annuloplasty Device is supplied on a Holder that
may be attached to a Handle to facilitate positioning the Device during
the procedure (Figure 2 on page 3). The Holder is machined from poly-
phenylsulfone and is attached to the annuloplasty Device using a single
suture (Figure 1 on page 3). The Device can be removed from the Holder
by severing the suture at any location along the face of the Holder.
Table of Contents
1. Device Labeling Symbols...................................................................2
2. Intended Use......................................................................................2
3. Indications for Use..............................................................................2
4. Annuloplasty Device Description........................................................2
4.1. Overview......................................................................................2
4.2. Technological Characteristics......................................................2
4.3. Accessories .................................................................................3
5. Contraindications................................................................................3
6. Warnings ............................................................................................3
7. Precautions.........................................................................................3
8. Magnetic Resonance (MR) Safety......................................................4
9. Potential Adverse Events ...................................................................4
10. How Supplied ..................................................................................4
10.1. Packaging..................................................................................4
10.2. Storage......................................................................................4
11. Directions for Use.............................................................................5
11.1. Sizing.........................................................................................5
11.2. Handling and Preparation Instructions ......................................5
11.3. Device Implantation...................................................................5
11.4. Sterilization................................................................................7
Disclaimer of Warranties ........................................................................7
Patents ...................................................................................................7

DWG-01-023 Rev. C - ©2021 3
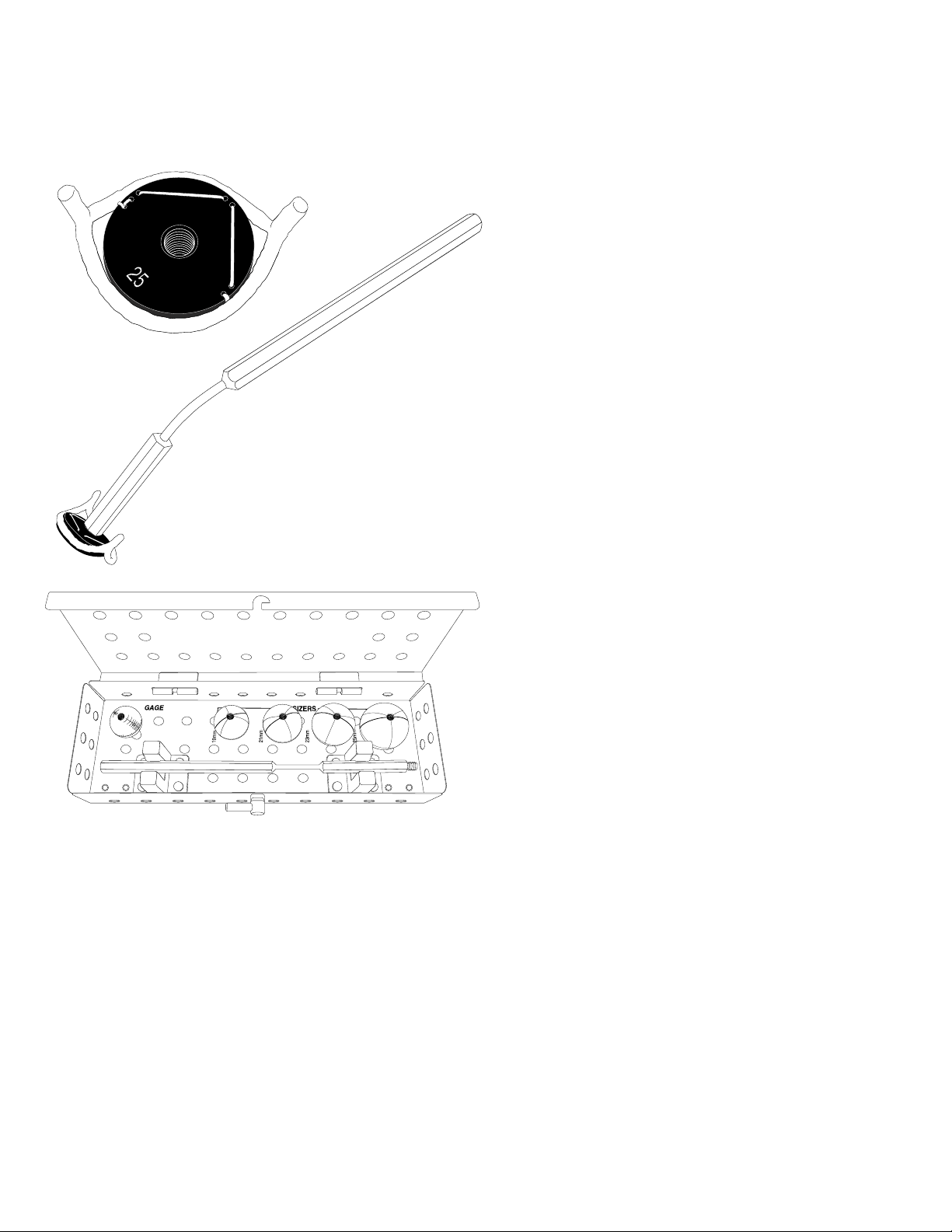
4.3. Accessories
The HAART 201 Instrument Set (Figure 3) is comprised of two (2) Han-
dles, four (4) Sizers and a Gage Sphere. Handles are made from ASTM
A276 stainless steel and the Sizers and Gage Sphere are fabricated
from polyphenylsulfone.
The Handle may be threaded into the Sizers and Gage Sphere. The
Handle may also be threaded into the face of the Holder to facilitate
removal of the Device from the packaging and positioning the Device
during the procedure (Figure 2). The Handle may be bent in the nar-
rowed section to present the Sizers, Gage Sphere, and Device to the
surgical site in the desired manner.
Warning: The Sizers, Gage Sphere, and Handle are intended for multi-
ple uses provided they are inspected before each use for signs of dam-
age. A cleaning and steam sterilization process has been validated for
these reusable instruments for use by the hospital. Before each use,
the Sizers and Gage Sphere should be visually inspected for crazing of
polymer materials, cracks, signs of structural weakness, or unreadable
Figure 1. HAART 200 Aortic Annuloplasty Device on holder
Figure 2. HAART 200 Aortic Annuloplasty
Device and holder affixed to handle
Figure 3. HAART 201 Instrument Set
markings. The Handle should be inspected for visible cracks or signs of
structural weakness before each use and after bending. Replace any
instrument that exhibits these faults as they may not function properly
and could cause patient injury. For more information on instruments, see
the HAART 201 Instrument Set IFU.
5. Contraindications
•The Device is contraindicated in patients with a porcelain aorta.
•The Device is contraindicated in patients with evolving bacterial
endocarditis.
•The Device is contraindicated in patients with heavily calcified valves.
6. Warnings
•The HAART 200 Aortic Annuloplasty Device is for Single Use
Only. Do not re-use the Device. In addition to the risks listed under
Complications, re-use may cause procedural complications including
Device damage, compromised Device biocompatibility, and Device
contamination. Re-use may result in infection, serious injury, or
patient death.
•The decision to use an annuloplasty device must be made by the
responsible physician on an individual basis after evaluation of the
risks and benefits accrued to the patient in comparison to alternate
treatment.
•Do not attempt to deform or reshape the annuloplasty Device.
•The HAART 200 Aortic Annuloplasty Device has been sterilized
by gamma irradiation methods and is provided sterile in a double
packaged container. No steam sterilization cycle has been validated
for the sterilization of the Device.
•Valve repair patients subjected to subsequent dental procedures or
other surgical procedures should receive prophylactic antibiotic drug
therapy to minimize the risk of systemic bacteremia and prosthetic
endocarditis.
•Correct annuloplasty device sizing is an important element of successful
valve repair. Significant undersizing can result in valve stenosis or ring
dehiscence. Oversizing can result in valve regurgitation. The size of
the HAART 200 Aortic Annuloplasty Device is selected using Sizers
consistent with the design intent of the Device. Use only the HAART
Sizers included in the HAART 201 Instrument Set to select the proper
Device size. Do not use the Holder as a sizing tool.
7. Precautions
•Only surgeons having received training in HAART Device implantation
and sizing techniques should use this Device.
•Aortic valve leaflet reconstruction is routinely required to create
valve competence during aortic valve repair. Annuloplasty using the
HAART Device should be combined with leaflet reconstruction when
indicated.
•Complex leaflet lesions including calcifications, fenestrations, per-
forations, nodular scarring and retraction, and tissue insufficiency
requiring patch materials may be a risk factor for repair failure.
•Do not use the Device after the expiration date printed on the label.
•To ensure the sterility and integrity of the Device, it should be stored
in the outer cardboard box until needed for introduction into the sterile
field. Do not use a Device that has been removed from the double
packaging and dropped, soiled, or otherwise damaged.
•Do not use the HAART 200 Aortic Annuloplasty Device if the tamper-
evident seal is damaged, broken or missing.
•Dispose of used Devices as biohazardous waste.

DWG-01-023 Rev. C - ©2021 4
•To avoid damage to the fabric covering the Device, do not use suture
needles with cutting edges during implantation.
•Implantation sutures should be placed deeply to position the HAART
devices at least 2 mm below the leaflet aortic junction and the tops of
the subcommissural triangles in order to prevent contact between the
leaflets and the Device.
•To prevent sutures from pulling through the native annular tissue,
Pledgets should be used with the sutures as described in the Direc-
tions for Use. A sufficient number of broad horizontal mattress sutures
should be used to eliminate gaps between the Device and the adja-
cent annular tissues and to support the tension associated with annu-
lar reduction.
•Sutures should be pulled tight and tied tightly so that the Device is in
firm contact with the adjacent annular tissues. Suture tails should be
tied down to the lateral aspect of the annular Pledgets, as described
in the Directions for Use, to prevent leaflet damage from long suture
tails. The sutures should also be cut very short.
•Provide careful monitoring of the patient’s anticoagulation status
when postoperative anticoagulation therapy is used. Surgeons who
use the HAART 200 Aortic Annuloplasty Device should be current on
anticoagulation regimens.
8. Magnetic Resonance (MR) Safety
MR Conditional
Non-clinical testing has demonstrated that the HAART 200 Aortic
Annuloplasty Device is MR Conditional. A patient with this device can
be safely scanned in an MR system meeting the following conditions:
•Static magnetic field of 1.5 T and 3 T
•Maximum spatial field gradient of 4,000 G/cm (40 T/m)
•Maximum MR system reported, whole body averaged specific
absorption rate (SAR) of 4.0 W/kg (First Level Controlled Operating
Mode) at 3 T
RF Heating
Under the scan conditions defined above, the HAART 200 Aortic Annu-
loplasty Device is expected to produce a maximum temperature rise of
less than 3.0°C after 15 minutes of continuous scanning.
Caution: The RF heating behavior does not scale with static field
strength. Devices that do not exhibit detectable heating at one field
strength may exhibit high values of localized heating at another field
strength.
MR Artifact
In non-clinical testing, the image artifact caused by the device extends
approximately 10 mm from the HAART 200 Aortic Annuloplasty Device
when imaged with a gradient echo pulse sequence and a 3 T MRI system.
9. Potential Adverse Events
Each prospective patient should be informed about the benefits and
risks of valve repair and annuloplasty surgery before the procedure.
Serious complications, including death, are possible with any open
heart surgery procedure including the implantation of the HAART 200
Aortic Annuloplasty Device. These potential complications include those
associated with open heart surgery in general and the use of general
anesthesia. The potential complications associated with the HAART 200
Aortic Annuloplasty Device and its implantation procedure are listed in
Table 1.
Table 1. Possible Complications Associated with the Device/Procedure
Abrasion of the natural valve Leaflet damage
Allergic reaction Left Ventricular Outow Tract
Obstruction
Angina Myocardial infarction
Aortic insufciency Neurological events
(including TIA, stroke, and
psychomotor decit)
Arrhythmia Pain (patient discomfort)
Atrioventricular block Pericardial effusion
Death Permanent pacemaker
Device explant Pleural effusion
Device fracture Psychological problems
Device migration or malposition
requiring intervention
Renal insufciency / failure
Endocarditis Reoperation
Extended surgery time or aborted
procedure
Respiratory system disorders
Fever Ring dehiscence
Gastrointestinal disorders Stenosis
Heart Failure Suture injury to coronary arteries
Hematoma Syncope
Hemolysis or hemolytic anemia Thrombosis or thromboembolism
Hemorrhage Toxic reaction
Hypertension Wound healing problems
Infection – local, bacteremia,
sepsis
10. How Supplied
10.1. Packaging
The HAART 200 Aortic Annuloplasty Device is available in 19, 21, 23
and 25 mm sizes. Each HAART 200 Aortic Annuloplasty Device shelf
box contains Pledgets and a single annuloplasty Device assembly
consisting of the Device sutured onto its corresponding Holder. The
assembled Device and Holder are packaged within nested, sealed
trays. Pledgets are packaged separately within nested pouches. The
packaging system is designed to ease placement of the Device into
the sterile field. The components within the packaging are sterile if the
pouches, trays, and lids are undamaged and unopened. The surfaces
of the outer packaging are NONSTERILE and must not be placed in
the sterile field.
10.2. Storage
Store the product in its original packaging, including the outer shelf
box, in a clean and dry area to protect the product and minimize the
potential for contamination. Stock rotation is recommended at regular
intervals to ensure usage before the expiration date printed on the box
label. Do not use the Device after the expiration date printed on the
label.
DWG-01-023 Rev. C - ©2021 5
11. Directions for Use
11.1. Sizing
The HAART 200 Aortic Annuloplasty Device size should be selected
based on the free-edge length of the non-fused valve leaflet. The free-
edge length is determined using the Sizers provided in the HAART 201
Instrument Set. Sizers are provided in 19, 21, 23, and 25 mm diame-
ters to correspond to the four HAART 200 Aortic Annuloplasty Device
sizes.
Correct annuloplasty device sizing is an important element of suc-
cessful valve repair. The appropriate HAART 200 Aortic Annuloplasty
Device size is selected by threading each individual Sizer onto the
Handle and inserting it behind the non-fused valve leaflet such that the
leaflet free-edge length between commissural insertions lies smoothly
along the circumference of the Sizer. The appropriate Sizer for a given
leaflet has been selected when the distance from one stippled area to
the other matches the leaflet free-edge length from one commissure
to the other (Figure 4). If the leaflet free-edge length is between two
sizes, choose the smaller of the two size options. The size number on
the corresponding Sizer indicates the appropriate Device size based
on the leaflet measured.
Figure 4. Proper sizing of leaflet free-edge length using the sizer
To confirm the device size selected with the Sizer, the distance between
the valve commisures can be measured using a valve sizer such as
a Hegar dilator. The objective of this measurement is to ensure the
diameter of the device chosen using the HAART 201 Sizers will not
cause excessive reduction of the intercommisural distance.
11.2. Handling and Preparation Instructions
Each Device is supplied mounted on a Holder and is packaged in nested,
sealed trays to ease transfer of the Device into the sterile field. Pledgets
are packaged within nested pouches. The inner pouches and sealed
trays should be inspected for damage prior to opening. Do not use the
Device if the sterile packaging has been compromised.
The Holder should be attached to the Handle contained within the
HAART 201 Instrument Set to facilitate removal of the Device from the
packaging and placement of the Device within the aortic root.
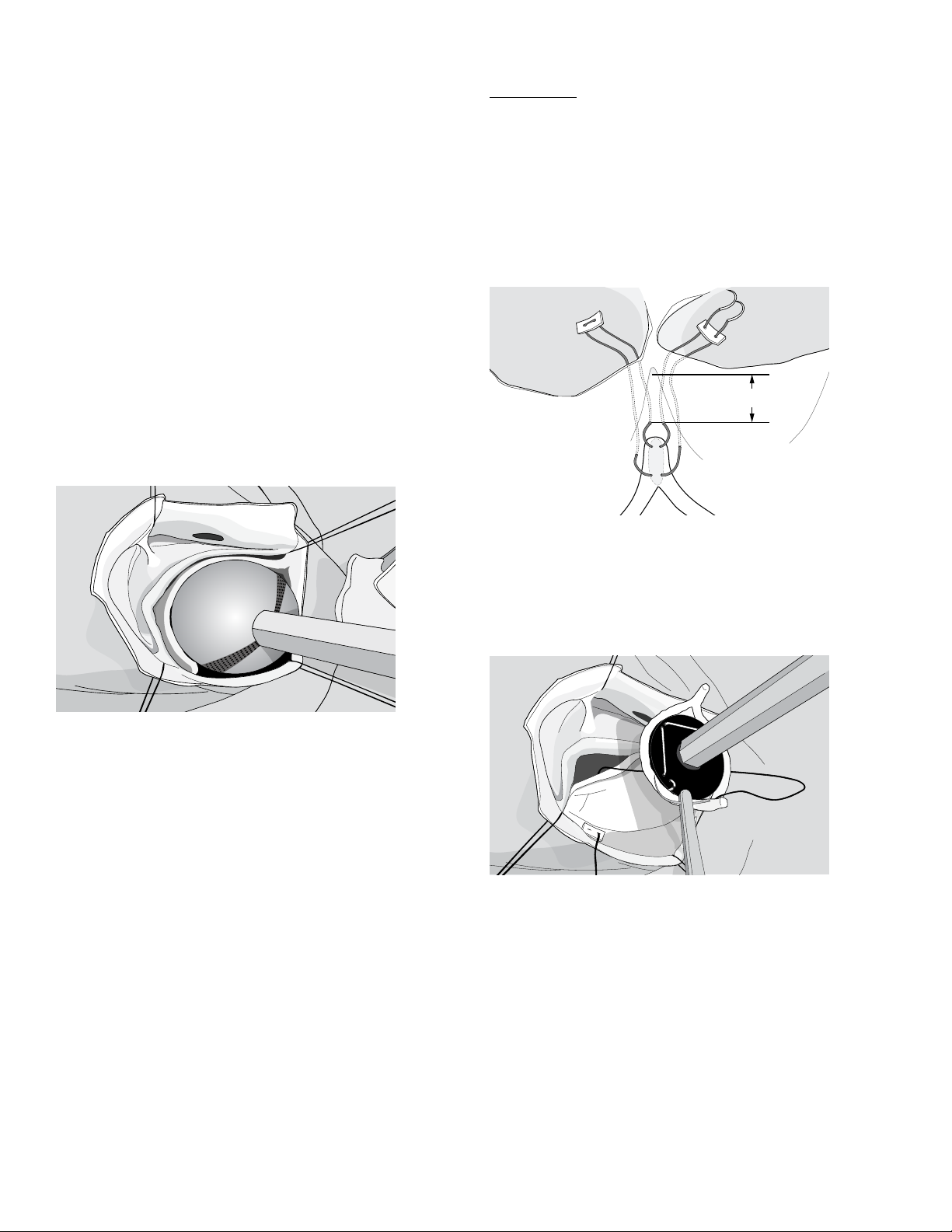
11.3. Device Implantation
Post Sutures
Insertion is begun by suturing the two posts of the Device to the two
subcommissural areas using “Cabrol-like” configurations with gener-
ous bites taken in the aortic wall, using 4-0 polypropylene horizontal
mattress sutures supported by Pledgets above the annulus (Figure 5).
Polypropylene suture is recommended for suturing the posts to facil-
itate easy tightening of the sutures and passage of the Device below
the valve.
Figure 5. Suturing technique for the
HAART 200 Aortic Annuloplasty Device Posts
2mm
Figure 6. Placing the post sutures
The post sutures are placed with the HAART 200 Aortic Annuloplasty
Device on the Holder above the valve (Figure 6). The post sutures
should be placed so that the tip of the device post will be positioned at
least 2mm below the top of the subcommissural space.
The HAART 200 Aortic Annuloplasty Device is covered with polyes-
ter fabric, which allows endothelialization. Horizontal mattress post
sutures are used primarily to correctly position the Device prior to
placement of additional looping sutures around the leaflet sections
of the Device. Only the horizontal mattress post sutures should catch
the fabric and then only just on the inside of the posts (Figure 5).
Extra fabric has been added in those areas to allow needle passage,
but only very superficial bites are required.
After the two post sutures are placed, the Device is lowered below the
native valve, and the suture attaching the Device to the Holder is cut.
The HAART 200 Aortic Annuloplasty Device must be removed gently
from the Holder, primarily by pushing the Device off the Holder near the
DWG-01-023 Rev. C - ©2021 6
center of each leaflet section of the Device. Only after the Device has
been pushed off the Holder should the Holder be removed from beneath
the valve.
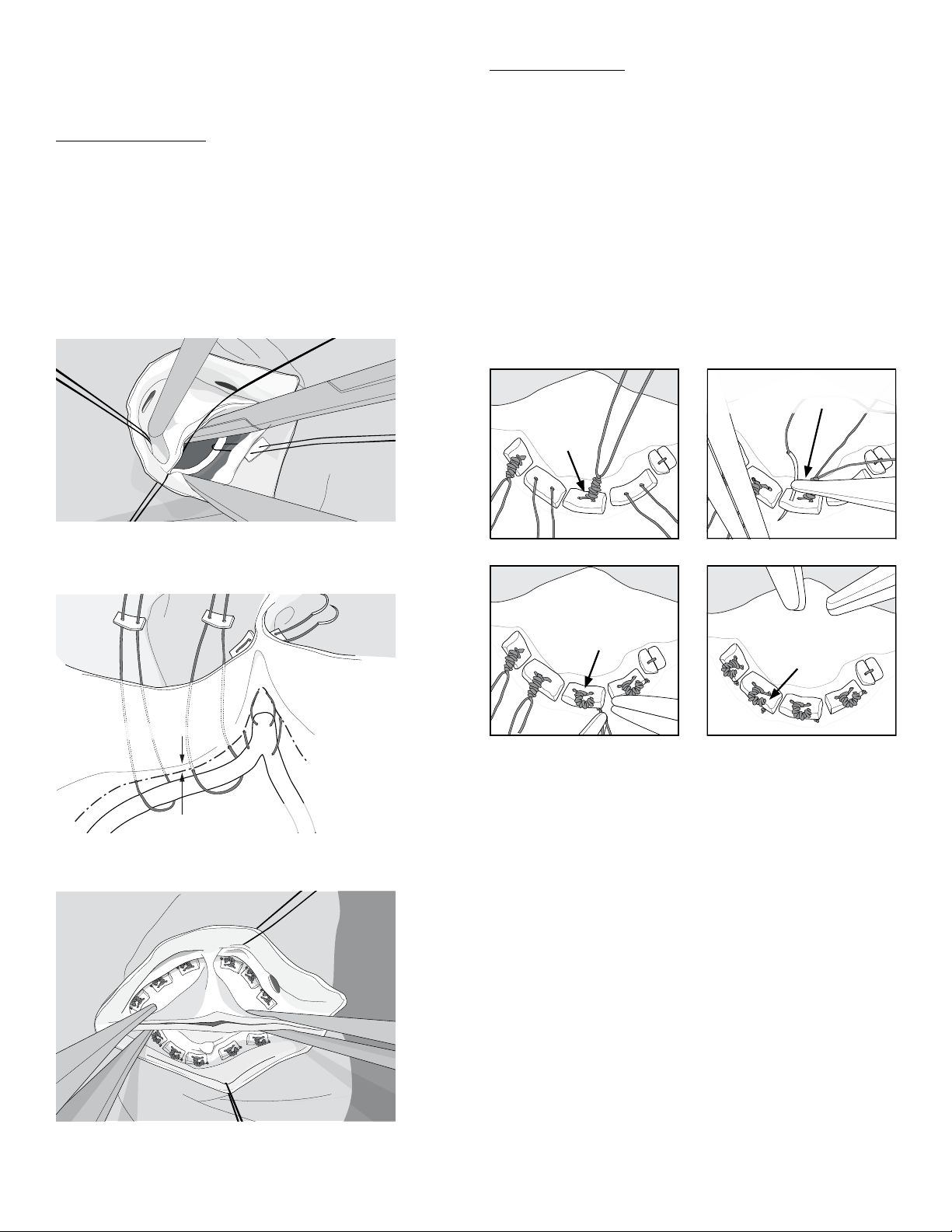
Sinus Section Sutures
Sinus section sutures loop around the Device and pass up through the
annulus, taking deep bites into the aorta and emerging above the valve
onto fine Pledgets (Figures 7 and 8). Use of 4-0 polypropylene suture is
recommended to allow the complex horizontal mattress sutures to be
pulled tightly at the ends. Three looping sutures are placed around the
non-fused sinus segment of the Device and four (4) looping sutures are
placed around the sinus segment corresponding to the fused leaflet, two
(2) on either side of the raphe (Figure 9).
2mm
Figure 7. Sinus section looping sutures
Figure 8. Suturing of the sinus sections with the device
below the valve leaflets.
Figure 9. Final suture configuration
Suture Management
After all nine sutures are placed, each is tied firmly over the Pledget with
8 knots, ensuring that the leaflet posts are buried back into the subcom-
missural regions and the Device fabric is kept below leaflet tissues. The
knots should be thoroughly tightened to prevent the sutures from coming
untied.
Long annular suture tails in the coronary sinus can cause leaflet injuries.
As a final step of annular suturing, one or both needles from the tied
annular suture should be passed downward through the center of the
lateral aspect of the Pledget, and the suture should be again tied down
to the Pledget with 6 more knots. This maneuver directs the suture tails
down and away from the leaflets.
Figure 10 illustrates the procedure for proper management of the
suture tails.
Suture tails and knots
are buried behind
Pledgets
DC
Suture tied again
and cut short
Needle passed through
Lateral Pledget
BA
Annulus
Leaflet
Suture tied
with 8 knots
Figure 10. Management of Annular Sutures
Panel A: The 4-0 polypropylene horizontal mattress sutures that hold
the Device firmly up under the annulus emerge above the annulus and
are supported by fine polyester Pledgets. The sutures are tied tightly
with 8 knots over the Pledgets (arrow). These suture lines are reducing
annular size significantly, and therefore, can be associated with signifi-
cant tension. Thus, extra care should be taken with tying good 8-throw
knots that will not come untied.
Panel B: Each suture is passed down through the lateral Pledget (arrow)
and tied again with 6 knots. This step positions the final knot and suture
tails laterally and under the Pledget.
Panel C: The suture tails are cut very short beneath the Pledgets (arrow).
Panel D: The double knot prevents each suture from coming untied, and
with the second knot beneath the Pledget, the suture tails are directed
laterally and down into the annulus, preventing contact with the leaflets.
At the end of the Device implant procedure, all annular sutures should
be carefully inspected by the surgeon, and if any question exists about
the position of a given suture tail, the knot tower should again be sutured
down and away from the leaflet with a fine 6-0 polypropylene suture.

DWG-01-023 Rev. C - ©2021 7
Figure 12. Geometric Height Scale (left) and
Effective Height Scale (right)
Leaflet Reconstruction
When indicated, leaflet reconstruction should be performed after annu-
loplasty Device insertion and according to established aortic leaflet recon-
struction techniques. Annuloplasty device insertion moves the annulus and
leaflets toward the center of the valve, but significant leaflet prolapse may
still be present. Leaflet prolapse may be corrected by plication sutures in the
leaflet free-edge, or by closing the cleft of a Type 1 valve. If present, struc-
tural leaflet defects may be corrected, using pericardial reconstruction or
other methods, consistent with the surgeon’s training and preferences. The
goal is to achieve equal lengths of both leaflets and equal effective heights
of > 8 mm.
Settepani F, Cappai A, Raffa G, et al. Cusp repair during aortic
valve-sparing operation: technical aspects and impact on results. J
Cardiovasc Med (Hagerstown). 2015 Apr;16(4):310-7.
Mazzitelli D, Stamm C, Rankin JS, et al. Leaflet reconstructive
techniques for aortic valve repair. Ann Thorac Surg. 2014
Dec;98(6):2053-60.
Assessment of Valve Repair
After completing the Device implantation and leaflet reconstruction,
the leaflets should be inspected and the aorta at the commissures
should be stretched laterally to assess relative leaflet lengths and
heights. Both leaflets should be equal in length and vertical with good
effective height and surface of coaptation. The leaflets should meet in
the midline with no evidence of central gaps or leaflet prolapse. Finally,
leaflets should be opened widely to ensure a good orifice.
Effective height and geometric height may be assessed using the
Gage Sphere provided in the HAART 201 Instrument Set (Figure 11).
The Gage Sphere has two different vertical scales marked on the sur-
face. One scale originates at the apex of the Sphere and is intended for
estimating the vertical effective height of the valve leaflet from the leaf-
let base to the free-edge margin (Figure 12). For a successful repair,
leaflet effective height should be approximately 8 to 10 mm. Thus, as
the Gage Sphere is gently pressed down into the leaflet-sinus com-
plex, a successful repair will be associated with the leaflet free-edge
being at the level of the Gage Sphere equator. The second scale may
be used to assess leaflet geometric lengths, when desired, for further
evaluation of leaflet size and symmetry after the overall valve repair.
Figure 11. Diagram of leaflet geometric height and effective height
Effective Height
11.4. Sterilization
The HAART 200 Aortic Annuloplasty Device is provided sterile on the
Holder and must not be resterilized. Devices that have been damaged
or contaminated should not be used. Pledgets are provided sterile and
must not be resterilized. Pledgets that have been damaged or contami-
nated from patient contact should not be used.
Disclaimer of Warranties
Although the HAART 200 Aortic Annuloplasty Device and HAART 201
Instrument Set, hereafter referred to as “product,” have been manufac-
tured under carefully controlled conditions, BioStable Science & Engi-
neering has no control over the conditions under which this product is
used. BioStable Science & Engineering and its affiliates (collectively,
“BioStable”), therefore, disclaims all warranties, both express and
implied, with respect to the product, including, but not limited to, any
implied warranty of merchantability or fitness for a particular purpose.
BioStable shall not be liable to any person or entity for any medical
expenses or any direct, incidental, or consequential damages caused
by any use, defect, failure, or malfunction of the product, whether a claim
for such damages is based upon warranty, contract, tort, or otherwise.
No person has any authority to bind BioStable to any representation or
warranty with respect to the product.
The exclusions and limitations set out above are not intended to, and
should not be construed so as to, contravene mandatory provisions of
applicable law. If any part or term of this Disclaimer of Warranty and
Limitation of Liability is held by any court of competent jurisdiction to be
illegal, unenforceable, or in conflict with applicable law, the validity of the
remaining portion of the Disclaimer of Warranty and Limitation of Liabil-
ity shall not be affected, and all rights and obligations shall be construed
and enforced as if this Disclaimer of Warranty and Limitation of Liability
did not contain the particular part or term held to be invalid.
Patents
Patents: US8,163,011; US8,425,594; US9,161,835; US9,814,574;
US9,844,434; US10,130,462; US10,327,891; CA 2,665,626; JP5881653;
JP5877205; JP6006218; EP2621407; EP2621408; other applications
pending.
Geometric
Height

DWG-01-023 Rev. C - ©2021 8
Инструкции за употреба – изделие за аортна
анулопластика HAART 200
Да не се използва
повторно
Срок на годност
Условно при МР
Стерилизирано с лъчение
Направете справка с
инструкциите за употреба
Продуктът отговаря на изискванията на Директива 93/42/
ЕИО относно медицинските изделия
Да не се стерилизира
повторно
1. Символи от етикетите на изделието
Производител
Да се пази сухо
Оторизиран европейски представител
Код на партидата
Каталожен номер
Да не се използва, ако
опаковката е повредена
MD
2. Предназначена употреба
Изделието за аортна анулопластика HAART 200 е предназначено
за употреба при коригиране на ануларна дилатация и/или
поддържане на ануларната геометрия на аортна клапа при
възрастни пациенти, подложени на корекция на бикуспидна
аортна клапа.
3. Индикации за употреба
Изделието за аортна анулопластика HAART 200 е показано при
възрастни пациенти, преминаващи корекция на бикуспидна
аортна клапа поради аортна инсуфициенция или съпътстващо при
корекция на аортна аневризма.
4. Описание на изделието за анулопластика
4.1. Общ преглед
Изделието за аортна анулопластика HAART 200 представлява
триизмерен пръстен за анулопластика, предназначен за корекция
на ануларна дилатация и/или поддържане на ануларната
геометрия на аортна клапа при възрастни пациенти, подложени
на корекция на бикуспидна аортна клапа. Изделието се състои от
титанова рамка, изработена от титан 6Al-4V от медицински клас,
покрита с полиестерна материя от медицински клас, прикрепена
към рамката чрез шев.
4.2. Технологични характеристики
Изделието за аортна анулопластика HAART 200 се състои от
три компонента: имплантируемото изделие за анулопластика,
полиестерни тампони и държач на изделието, който се изхвърля
по време на процедурата. Всеки от тези компоненти е описан
накратко по-долу.
Изделие за анулопластика
Изделието за аортна анулопластика HAART 200 има геометрия
с кръгла основа с две изпъкващи на 10° субкомисурни рамена,
разположени на 180° по обиколката на изделието. Изделието за
анулопластика се състои от титанова рамка, изработена от титан
6Al-4V от медицински клас, покрита с полиестерна материя от
медицински клас, прикрепена към рамката чрез шев. Материалите
на изделието и производствените процеси са специално
подбрани за употреба при имплантируемо медицинско изделие.
Полиестерната тъкан ARF001 се произвежда за приложения в
пръстени за анулопластика. Изделията за аортна анулопластика
HAART 200 се произвеждат в 4 размера, вариращи от 19 mm до 25
mm през 2 mm.
Титановата рамка на изделието осигурява твърдост за намаляване
на диаметъра на разширения аортен анулус, докато полиестерната
тъкан осигурява материал за подпомагане на ендотелизирането
и директното зашиване на субкомисурните рамена към аортния
клапен анулус. Вътрешните части на рамената на изделието имат
2 слоя полиестерна тъкан, за да се улесни зашиването.
Полиестерни тампони
Полиестерните тампони са 7 mm на 3 mm и са изработени от
същата тъкан ARF001, използвана за покриване на изделието.
Тампоните се предоставят с изделието за анулопластика за
употреба по време на операция. Те се предоставят стерилни в
Съдържание
BULGARIAN
1. Символи от етикетите на изделието ...............................................8
2. Предназначена употреба .................................................................8
3. Индикации за употреба ....................................................................8
4. Описание на изделието за анулопластика .....................................8
4.1. Общ преглед ..............................................................................8
4.2. Технологични характеристики ..................................................8
4.3. Аксесоари ...................................................................................9
5. Противопоказания ............................................................................9
6. Предупреждения ...............................................................................9
7. Предпазни мерки ............................................................................10
8. Безопасност при магнитен резонанс (МР) ....................................10
9. Потенциални нежелани събития ...................................................10
10. Как се доставя ............................................................................... 11
10.1. Опаковка ................................................................................. 11
10.2. Съхранение ............................................................................ 11
11. Инструкции за употреба ............................................................... 11
11.1. Оразмеряване ........................................................................ 11
11.2. Инструкции за работа и подготовка...................................... 11
11.3. Имплантиране на изделието ................................................. 11
11.4 Стерилизиране ........................................................................14
Отказ от гаранции ...............................................................................14
Патенти ................................................................................................14

DWG-01-023 Rev. C - ©2021 9
отделна опаковка в кутията за съхранение на изделието. Също
така са налични индивидуални опаковки с по 6 стерилни тампона в
комплекта от 6 броя полиестерни тампони HAART.
Държач
Изделието за аортна анулопластика HAART 200 се предоставя
върху държач, който може да бъде прикрепен към дръжка, за да се
улесни позиционирането на изделието по време на процедурата
(Фигура 2). Държачът е изработен от полифенилсулфон и е
прикрепен към изделието за анулопластика с помощта на един
шев (Фигура 1). Изделието може да бъде откачено от държача чрез
прекъсване на шева на което и да е място от предната страна на
държача.
4.3. Аксесоари
Комплектът с инструменти HAART 201 (Фигура 3) се състои
от две (2) дръжки, четири (4) оразмерителя и една измерваща
сфера. Дръжките са направени от неръждаема стомана ASTM
A276, а оразмерителите и измерващата сфера са произведени от
полифенилсулфон.
Фигура 1. Изделие за аортна анулопластика HAART 200 на
държач
Фигура 2. Изделие за аортна
анулопластика HAART 200 и държач,
фиксирани на дръжка
Фигура 3. Комплект с инструменти HAART 201
Дръжката може да бъде завита в оразмерителите и измерващата
сфера. Дръжката може също така да бъде завита за предната
страна на държача, за да се улесни изваждането на изделието
от опаковката и позиционирането му по време на процедурата
(Фигура 2). Дръжката може да бъде огъната в стеснения участък за
поставяне на оразмерителите, измерващата сфера и изделието
на хирургичното място по желания начин.
Предупреждение: Оразмерителите, измерващата сфера и
дръжката са предназначени за многократна употреба, при
условие че преди всяка употреба се проверяват за признаци
на повреда. За тези инструменти за многократна употреба е
валидиран болничен процес на почистване и стерилизация с пара.
Преди всяка употреба оразмерителите и измерващата сфера
трябва да се проверяват визуално за повреда на полимерните
материали, пукнатини, признаци на структурна слабост или
нечетливи маркировки. Дръжката трябва да се проверява за
видими пукнатини или признаци на структурна слабост преди
всяка употреба и след огъване. Сменете всеки инструмент, който
има тези неизправности, тъй като той може да не функционира
правилно и да причини нараняване на пациента. За повече
информация относно инструментите вижте ИЗУ на комплекта с
инструменти HAART 201.
5. Противопоказания
•Изделието е противопоказано при пациенти с порцеланова
аорта.
•Изделието е противопоказано при пациенти с развиващ се
бактериален ендокардит.
•Изделието е противопоказано при пациенти със силно
калцирани клапи.
6. Предупреждения
•Изделието за аортна анулопластика HAART 200 е
предназначено само за еднократна употреба. Не използвайте
изделието повторно. В допълнение към рисковете, изброени
в „Усложнения“, повторната употреба може да причини
процедурни усложнения, включително повреда на изделието,
компрометирана биосъвместимост на изделието и замърсяване
на изделието. Повторната употреба може да доведе до
инфекция, сериозно нараняване или смърт на пациента.
•Решението за използване на изделието за анулопластика
трябва да бъде взето от лекуващия лекар според индивидуалния
случай след оценка на рисковете и ползите за пациента в
сравнение с алтернативно лечение.
•Не се опитвайте да деформирате или променяте формата на
изделието за анулопластика.
•Изделието за аортна анулопластика HAART 200 е
стерилизирано чрез методи на гама-облъчване и се предлага
стерилно в контейнер с двойна опаковка. За стерилизация на
изделието не е валидиран цикъл на стерилизация с пара.
•Пациентите с корекция на клапа, подложени на последващи
дентални процедури или други хирургични процедури, трябва
да получат профилактична антибиотична медикаментозна
терапия, за да минимизират риска от системна бактериемия и
протезен ендокардит.
•Правилното оразмеряване на изделието за анулопластика
е важен елемент от успешната клапна корекция. Изборът на
много по-малък размер може да доведе до стеноза на клапата
или дехисценция на пръстена. Изборът на по-голям размер

DWG-01-023 Rev. C - ©2021 10
може да доведе до регургитация на клапата. Размерът на
изделието за аортна анулопластика HAART 200 се избира с
помощта на оразмерители, съобразени с предназначението
на дизайна на изделието. Използвайте само оразмерители
HAART, включени в комплекта с инструменти HAART 201, за
да изберете правилния размер на изделието. Не използвайте
държача като инструмент за оразмеряване.
7. Предпазни мерки
•Изделието трябва да се използва само от хирурзи, преминали
обучение по техники за имплантация и оразмеряване на
изделието HAART.
•Често е необходима реконструкцията на аортните клапни
платна, за да се постигне компетентност на клапата при аортна
клапна корекция. Анулопластиката с помощта на изделието
HAART трябва да се комбинира с реконструкция на платната,
когато е индикирано.
•Комплексни лезии на платната, включително калцификации,
фенестрации, перфорации, нодуларни скарификации и
ретракция и тъканна инсуфициенция, изискващи материали за
ламбо, могат да бъдат рисков фактор за неуспех на корекцията.
•Не използвайте изделието след срока на годност, отпечатан на
етикета.
•За да се гарантира стерилността и целостта на изделието,
то трябва да се съхранява във външната картонена кутия до
момента на въвеждане в стерилното поле. Не използвайте
изделие, което е извадено от двойната опаковка и е изпуснато,
замърсено или повредено по друг начин.
•Не използвайте изделието за аортна анулопластика HAART
200, ако запечатването с индикация за отваряне е повредено,
разкъсано или липсва.
•Изхвърляйте използваните изделия като биоопасни отпадъци.
•За да избегнете повреда на материала, покриващ изделието,
по време на имплантацията не използвайте игли за зашиване с
режещи ръбове.
•Шевовете за имплантация трябва да се поставят дълбоко,
за да позиционират изделието HAART на поне 2 mm под
свързването на аортните платна и върховете на субкомисурните
триъгълници, за да се предотврати контакт между платната и
изделието.
•За да се предотврати изтеглянето на шевове през нативната
ануларна тъкан, с конците трябва да се използват тампони,
както е описано в инструкциите за употреба. Трябва да се
използват достатъчен брой широки хоризонтални матрацни
шевове, за да се премахне разстоянието между изделието и
прилежащите ануларни тъкани и да се поддържа напрежението
от ануларната редукция.
•Шевовете трябва да се стегнат и завържат здраво, така че
изделието да е в добър контакт със съседните ануларни тъкани.
Свободните краища на шевовете трябва да бъдат скрити в
латералните части на ануларните тампони, както е описано в
инструкциите за употреба, за да се предотврати увреждане на
платната от дълги свободни краища на шевовете. Също така
шевовете трябва да се срежат много ниско.
•Осигурете внимателно проследяване на антикоагулационния
статус на пациента, когато се използва постоперативна
антикоагулационна терапия. Хирурзите, които използват
изделието за аортна анулопластика HAART 200, трябва да са
информирани за настоящите антикоагулационни схеми.
8. Безопасност при магнитен резонанс (МР)
PУсловно при МР
Неклиничните тестове показват, че изделието за аортна
анулопластика HAART 200 е условно при МР. Пациент с това
изделие може безопасно да бъде сканиран в система за МР,
отговаряща на следните условия:
•Статично магнитно поле от 1,5 T и 3 T
•Максимален градиент на пространственото поле от 4000 G/cm
(40 T/m)
•Отчетена максимална система за МР, усреднена за цялото
тяло специфична скорост на поглъщане (SAR) от 4,0 W/kg
(контролиран режим от първо ниво) при 3 T
РЧ нагряване
При условията на сканиране, дефинирани по-горе, изделието
за аортна анулопластика HAART 200 се очаква да доведе до
максимално повишаване на температурата от по-малко от 3,0°C
след 15 минути непрекъснато сканиране.
Внимание: Поведението на РЧ нагряване не се мащабира
спрямо статична сила на полето. Изделията, които не показват
забележимо нагряване при една сила на полето, могат да показват
високи стойности на локално нагряване при друга сила на полето.
Артефакт при МР
При неклинично тестване артефактът на изображението, причинен
от изделието, се простира приблизително на 10 mm от изделието
за аортна анулопластика HAART 200, когато се изобразява с
градиентна ехо импулсна последователност и система за ЯМР от
3 T.
9. Потенциални нежелани събития
Всеки бъдещ пациент трябва да бъде информиран за предимствата
и рисковете от клапна корекция и оперативна анулопластика
преди процедурата. При всяка процедура на отворена сърдечна
операция, включително имплантиране на изделие за аортна
анулопластика HAART 200, са възможни сериозни усложнения,
включително смърт. Тези потенциални усложнения включват
усложненията, свързани с отворена сърдечна операция като цяло
и използването на обща анестезия. Потенциалните усложнения,
свързани с изделието за аортна анулопластика HAART 200 и
неговата имплантационна процедура, са изброени в Таблица 1.
Таблица 1. Възможни усложнения, свързани с изделието/
процедурата
Абразия на естествената клапа Алергична реакция
Стенокардия Аортна инсуфициенция
Аритмия Атриовентрикуларен блок
Смърт Експлантация на изделието
Счупване на изделието Миграция или малпозиция
на изделието, изискващи
интервенция
Ендокардит Удължено оперативно време
или прекратена процедура
Треска Стомашно-чревни нарушения
Сърдечна недостатъчност Хематом
Хемолиза или хемолитична
анемия
Кръвоизлив
DWG-01-023 Rev. C - ©2021 11
Хипертензия Инфекция – локална,
бактериемия, сепсис
Клапна увреда Обструкция на левокамерен
изходен поток
Миокарден инфаркт Неврологични събития
(включително ТИА, инсулт и
психомоторен дефицит)
Болка (дискомфорт на
пациента)
Перикарден излив
Постоянен пейсмейкър Плеврален излив
Психологични проблеми Бъбречна инсуфициенция/
недостатъчност
Реоперация Заболявания на дихателната
система
Дехисценция на пръстена Стеноза
Увреждане на коронарните
артерии от шевовете
Синкоп
Тромбоза или тромбоемболия Токсична реакция
Проблеми със заздравяването
на раната
10. Как се доставя
10.1. Опаковка
Изделието за аортна анулопластика HAART 200 се предлага в
размери 19, 21, 23 и 25 mm. Всяка кутия за съхранение на изделие
за аортна анулопластика HAART 200 съдържа тампони и комплект
единично изделие за анулопластика, състоящ се от изделието,
зашито върху съответния държач. Комплектът от изделие и
държач е опакован в оформени и запечатани тави. Тампоните са
опаковани отделно в плътни торбички. Системата за опаковане е
проектирана да улесни поставянето на изделието в стерилното
поле. Компонентите в опаковката са стерилни, ако торбичките,
тавите и капаците са неповредени и неотворени. Повърхностите
на външната опаковка са НЕСТЕРИЛНИ и не трябва да се поставят
в стерилното поле.
10.2. Съхранение
Съхранявайте продукта в оригиналната му опаковка, включително
външната кутия за съхранение, на чисто и сухо място, за да
защитите продукта и да сведете до минимум опасността от
замърсяване. Препоръчва се редуване на съхраняваните
продукти на редовни интервали, за да се гарантира използването
преди датата на изтичане, отпечатана на етикета на кутията.
Не използвайте изделието след срока на годност, отпечатан на
етикета.
11. Инструкции за употреба
11.1. Оразмеряване
Размерът на изделието за аортна анулопластика HAART 200
трябва да бъде избран въз основа на дължината на свободния
ръб на несъединеното клапно платно. Дължината на свободния
ръб се определя с помощта на оразмерителите, предоставени в
комплекта с инструменти HAART 201. Предлагат се оразмерители
с диаметър 19, 21, 23 и 25 mm, за да съответстват на четирите
размера на изделието за аортна анулопластика HAART 200.
Фигура 4. Правилно оразмеряване на дължината на свободния
ръб на платното с помощта на оразмерителя
Правилното оразмеряване на изделието за анулопластика е важен
елемент от успешната клапна корекция. Подходящият размер на
изделието за аортна анулопластика HAART 200 се избира, като се
наниже всеки отделен оразмерител на дръжката и се постави зад
несъединеното клапно платно, така че дължината на свободния
ръб на платното между комисурните инсерции да лежи гладко
по обиколката на оразмерителя. Подходящият размер за дадено
платно се избира, като разстоянието от едната набраздена зона
до другата съвпада с дължината на свободния ръб на платното от
една комисура до друга (Фигура 4). Ако дължината на свободния
ръб на платното е между два размера, изберете по-малкия от
двата варианта за размер. Номерът на размера на съответния
оразмерител показва подходящия размер на изделието въз
основа на измереното платно.
За да се потвърди размерът на изделието, избран чрез
оразмерител, разстоянието между комисурите на платното може
да бъде измерено с помощта на оразмерител за платно, като
например дилататор на Hegar. Целта на това измерване е да
се гарантира, че диаметърът на изделието, избран с помощта
на оразмерителите HAART 201, няма да доведе до прекомерно
намаляване на междукомисурното разстояние.
11.2. Инструкции за работа и подготовка
Всяко изделие се доставя монтирано на държач и е опаковано в
оформени, запечатани тави, за да се улесни прехвърлянето на
изделието в стерилното поле. Тампоните са опаковани в плътни
торбички. Вътрешните торбички и запечатаните тави трябва да
бъдат проверени за повреди преди отваряне. Не използвайте
изделието, ако стерилната опаковка е нарушена.
Държачът трябва да бъде прикрепен към дръжката, съдържаща се в
комплекта с инструменти HAART 201, за да се улесни изваждането
на изделието от опаковката и поставянето му в корена на аортата.
11.3. Имплантиране на изделието
Шевовете на рамената
Вкарването започва чрез зашиване на двете рамена на изделието
към двете субкомисурни зони, използвайки конфигурации, подобни
на Cabrol, със захващане на достатъчно тъкан в аортната стена,
като се използват 4-0 полипропиленови хоризонтални матрацни
шевове, поддържани от тампони над анулуса (Фигура 5 на страница
12). За зашиване на рамената се препоръчва полипропиленов
шев, за да се улесни затягането на конците и преминаването на
изделието под клапата.

DWG-01-023 Rev. C - ©2021 12
Шевовете на рамената се поставят, като изделието за аортна
анулопластика HAART 200 е на държача над клапата (Фигура 6).
Шевовете на рамената трябва да бъдат поставени така, че върхът
на рамото на изделието да бъде разположен най-малко на 2 mm
под горната част на субкомисурното пространство.
Фигура 7. Контурни шевове в областта на платната
2mm
Фигура 8. Зашиване в областта на платната, като изделието
е под клапните платна.
Фигура 9. Финална конфигурация на шевовете.
изтеглят плътно в краищата. Три контурни шева се поставят около
несъединения синусов сегмент на изделието и четири (4) контурни
шева се поставят около синусовия сегмент, съответстващ на
съединеното платно, два (2) от двете страни на шева (Фигура 9).
Фигура 5. Техника на зашиване на рамената на изделието за
аортна анулопластика HAART 200
2mm
Фигура 6. Поставяне на шевовете на рамената
Изделието за аортна анулопластика HAART 200 е покрито
с полиестерна материя, която позволява ендотелизация.
Хоризонталните матрацни шевове се използват предимно за
правилно позициониране на изделието преди поставяне на
допълнителни контурни шевове около областите за платната на
изделието. Само хоризонталните матрацни шевове на рамената
трябва да захващат материята и то само от вътрешната страна
на рамената (Фигура 5). В тези зони е добавена допълнителна
материя, която позволява преминаване на иглата, но се изискват
само много повърхностни захващания.
След поставянето на двата шева на рамената, изделието се спуска
под нативната клапа и шевът, прикрепящ изделието към държача,
се срязва. Изделието за аортна анулопластика HAART 200
трябва да бъде отстранено внимателно от държача, главно чрез
избутване на изделието от държача близо до центъра на всяка
област за платно на изделието. Едва след като изделието бъде
избутано от държача, той може да бъде изваден изпод клапата.
Шевове в областта на синуса
Шевовете в областта на синуса заобикалят изделието и
преминават през анулуса, като захващат достатъчно тъкан в
аортата и излизат над клапата в малки тампони (Фигури 7 и 8).
Препоръчва се използването на 4-0 полипропиленов шев, за
да се позволи сложните хоризонтални матрацни шевове да се
Работа с шевовете
След поставянето на всичките девет шева, всеки се стяга добре
над тампон с 8 възела, като се гарантира, че рамената на платната
са навътре в субкомисурните области и материята на изделието се
намира под тъканта на платната. Възлите трябва да бъдат добре
затегнати, за да се предотврати развързването на шевовете.
Дългите краища на ануларни конци в коронарния синус могат
да причинят нараняване на платната. Като последна стъпка
от ануларното зашиване, едната или двете игли от завързания
ануларен шев трябва да се прекарат надолу през центъра на

DWG-01-023 Rev. C - ©2021 13
латералната част на тампона, а шевът отново трябва да се стегне
към тампона с още 6 възела. Този подход насочва краищата на
конците надолу и далеч от платната.
Фигура 10 илюстрира процедурата за правилна работа с краищата
на конците.
да има значителен пролапс на платната. Пролапсът на платната
може да бъде коригиран чрез пликационни шевове на свободния
ръб на платното или чрез затваряне на цепнатината на клапа тип
1. Ако са налице, структурните дефекти на платната могат да
бъдат коригирани с помощта на перикардна реконструкция или
други методи, съответстващи на обучението и предпочитанията
на хирурга. Целта е да се постигне еднаква дължина на двете
платна и еднакви ефективни височини >8 mm.
Settepani F, Cappai A, Raffa G, et al. Cusp repair during aortic
valve-sparing operation: technical aspects and impact on results. J
Cardiovasc Med (Hagerstown). 2015 Apr;16(4):310-7.
Mazzitelli D, Stamm C, Rankin JS, et al. Leaflet reconstructive
techniques for aortic valve repair. Ann Thorac Surg. 2014
Dec;98(6):2053-60.
Оценка на клапната корекция
След завършване на имплантирането на изделието и
реконструкцията на платната, последните трябва да бъдат
инспектирани и аортата в комисурите да бъде разпъната
латерално, за да се оценят относителните дължини и височини
на платната. И двете платна трябва да са еднакви по дължина и
вертикално да са с добра ефективна височина и повърхност на
коаптация. Платната трябва да се срещат по средната линия, без
да има данни за дупки между тях или пролапс на платната. Не на
последно място платната трябва да се отварят широко, за да се
осигури добър отвор.
Ефективната височина и геометричната височина могат да
бъдат оценени с помощта на измерваща сфера, предоставена в
комплекта с инструменти HAART 201 (Фигура 11). Измерващата
сферата има две различни вертикални скали, маркирани на
повърхността. Една скала започва от върха на сферата и е
предназначена за оценка на вертикалната ефективна височина на
клапното платно от основата на платното до ръба на свободния
ръб (Фигура 12). За успешна корекция ефективната височина на
платното трябва да бъде приблизително 8 до 10 mm. По този
начин, докато измерващата сфера внимателно се притиска надолу
към комплекса платно-синус, успешна корекция ще бъде свързана
със свободния ръб на платното, който е на нивото на екватора на
измерващата сфера. Втората скала може да се използва за оценка
на геометричните дължини на платната, когато е необходимо, за
по-нататъшна оценка на размера и симетрията на платната след
цялостната корекция на клапата.
Краищата на конците
и възлите се скриват зад
тампоните
DC
Шевът е завързан
отново
Иглата преминава през
латералната част на тампона
B
A
Анулус
Платно
Шев, завързан
с 8 възела
Фигура 10. Работа с ануларните шевове.
Панел А: Полипропиленови 4-0 хоризонтални матрацни шевове,
които държат изделието здраво нагоре под анулуса, излизат над
него и се поддържат от фини полиестерни тампони. Шевовете са
стегнати плътно с 8 възела над тампоните (стрелка). Тези конци на
шевовете намаляват значително ануларния размер и следователно
могат да бъдат свързани със значително напрежение. Поради това
трябва да се внимава за сигурното връзване на 8 двойни възела,
които няма да се развържат.
Панел B: Всеки шев преминава през латералния тампон (стрелка)
и се връзва отново с 6 възела. Тази стъпка позиционира крайния
възел и краищата на конците латерално и под тампона.
Панел C: Краищата на конците се изрязват много късо под
тампоните (стрелка).
Панел D: Двойният възел предотвратява развързването на
всеки шев, а с втория възел под тампона краищата на конците са
насочени латерално и надолу в пръстена, избягвайки контакт с
платната.
В края на процедурата за имплантиране на изделието всички
ануларни шевове трябва да бъдат внимателно инспектирани от
хирурга и ако има някакъв въпрос относно позицията на даден край
на конец, последователността от възли трябва отново да бъде
зашита надолу и далеч от платното с фин 6-0 полипропиленов
конец.
Реконструкция на платната
Когато е индикирано, трябва да се извърши реконструкция на
платната след въвеждане на изделието за анулопластика и
съгласно установените техники за реконструкция на аортни
платна. Въвеждането на изделието за анулопластика премества
анулуса и платната към центъра на клапата, но все още може
Фигура 11. Диаграма на клапната геометрична височина и
ефективната височина
Ефективна височина
геометрична
височина

DWG-01-023 Rev. C - ©2021 14
11.4 Стерилизиране
Изделието за аортна анулопластика HAART 200 се предоставя
стерилно върху държача и не трябва да се стерилизира повторно.
Изделия, които са били повредени или замърсени, не трябва да
се използват. Тампоните се предоставят стерилни и не трябва да
се стерилизират повторно. Тампони, които са били повредени или
замърсени от контакт с пациента, не трябва да се използват.
Отказ от гаранции
Въпреки че изделието за аортна анулопластика HAART 200 и
комплектът с инструменти HAART 201, наричани по-долу „продукт“,
са произведени при внимателно контролирани условия, BioStable
Science & Engineering няма контрол върху условията, при които този
продукт се използва. Следователно BioStable Science & Engineering
и нейните филиали (наричани заедно „BioStable“) отхвърля всички
гаранции, както изрични, така и подразбиращи се, по отношение
на продукта, включително, но не само, всяка подразбираща се
гаранция за продаваемост или годност за определена цел. Bio-
Stable не носи отговорност пред физическо или юридическо лице
за каквито и да е медицински разходи или каквито и да било
преки, случайни или последващи щети, причинени от каквато и
да е употреба, дефект, повреда или неизправност на продукта,
независимо дали искът за такива щети се основава на гаранция,
договор, деликт или по друг начин. Никое лице няма право да
обвързва BioStable с каквото и да е представяне или гаранция по
отношение на продукта.
Изложените по-горе изключения и ограничения не са
предназначени и не трябва да се тълкуват така, че да
противоречат на задължителните разпоредби на приложимото
право. Ако някоя част от или условие на настоящите „Отказ от
гаранции“ и „Ограничаване на отговорността“ се считат от който
и да е съд с компетентна юрисдикция за незаконни, неприложими
или в противоречие с приложимото законодателство, валидността
на останалата част от „Отказ от гаранции“ и „Ограничаване
на отговорността“ няма да бъде засегната и всички права и
задължения ще се тълкуват и прилагат така, сякаш тези „Отказ
от гаранции“ и „Ограничаване на отговорността“ не съдържат
конкретната част или условие, считани за невалидни.
Патенти
Патенти: US8,163,011; US8,425,594; US9,161,835; US9,814,574;
US9,844,434; US10,130,462; US10,327,891; CA 2,665,626; JP5881653;
JP5877205; JP6006218; EP2621407; EP2621408; изчакват се други
заявления.
Фигура 12. Скала за дължина (вляво) и скала за ефективна
височина (вдясно) на платното

DWG-01-023 Rev. C - ©2021 15
Návod k použití -
Zařízení k aortální anuloplastice HAART 200
Nepoužívejte opakovaně
Datum spotřeby
Podmíněně kompatibilní
s prostředím MR
Sterilizováno zářením
Prostudujte si návod k použití
Produkt splňuje požadavky směrnice 93/42/EHS o
zdravotnických prostředcích.
Neresterilizujte
1. Symboly značení na zařízení
Výrobce
Uchovávejte v suchu
Autorizovaný zástupce pro Evropu
Kód šarže Katalogové číslo
Nepoužívejte, pokud je obal poškozen
MD
2. Zamýšlené použití
Zařízení k aortální anuloplastice HAART 200 je určené k nápravě
anulární dilatace a/nebo udržení anulární geometrie aortální chlopně
u dospělých pacientů podstupujících rekonstrukci bicuspidální aortální
chlopně kvůli jejímu onemocnění.
3. Indikace pro použití
Zařízení HAART 200 k aortální anuloplastice je indikováno u dospělých
pacientů podstupujících opravu bicuspidální aortální chlopně pro aor-
tální nedostatečnost nebo při opravě aortálního aneuryzmatu.
4. Popis zařízení k anuloplastice
4.1. Přehled
Zařízení k aortální anuloplastice HAART 300 je trojrozměrný anuloplas-
tický kroužek určený k opravě anulární dilatace a/nebo udržení anulární
geometrie aortální chlopně u dospělých pacientů podstupujících opravu
bicuspidální aortální chlopně. Zařízení sestává z titanového rámu vyro-
beného z titanu 6Al-4V určeného k použití ve zdravotnictví pokrytého
polyesterovou látkou určenou k použití ve zdravotnictví připojenou k
rámu šicím materiálem.
4.2. Technologické charakteristiky
Zařízení k aortální anuloplastice HAART 200 sestává ze tří součástí:
implantabilní zařízení k anuloplastice, polyesterové zátky a držák
zařízení, který se během zákroku zlikviduje. Jednotlivé součásti jsou
podrobněji popsané níže.
Zařízení k anuloplastice
The HAART 200 Aortic Annuloplasty Device has a circular base
geomZařízení k aortální anuloplastice HAART 200 má kruhovou geo-
metrii základny se dvěma o 10 stupňů směrem ven otočenými sub-
komisurálními kolíčky umístěnými v rozsahu 180 stupňů kolem obvodu
zařízení. Zařízení k anuloplastice sestává z titanového rámu vyrobeného
z titanu 6Al-4V určeného k použití ve zdravotnictví pokrytého polyestero-
vou látkou určenou k použití ve zdravotnictví připojenou k rámu šicím
materiálem. Materiály zařízení a výrobní procesy byly specificky zvo-
lené k použití v implantabilním lékařském zařízení. Polyesterová látka,
ARF001, se vyrábí k použití v anuloplastických prstencích. Zařízení k
aortální anuloplastice HAART 200 se vyrábí ve 4 velikostech v rozsahu
19 až 25 mm v krocích po 2 mm.
Titanový rám zařízení poskytuje dostatečnou tuhost umožňující
zmenšení průměru dilatovaného aortálního anulu. Polyesterová látka je
nosným materiálem pro endotelizaci a přímé přišívání subkomisurálních
kolíčků k anulu aortální chlopně. Vnitřní strany kolíčků zařízení mají 2
vrstvy polyesterové látky ulehčující přišívání.
Polyesterové zátky
Polyester Pledgets are 7mm by 3mm and are made from the same Poly-
esterové zátky měří 7 × 3 mm a vyrábí se ze stejné látky ARF001 použité
v zařízení. Zátky se dodávají se zařízením k anuloplastice a jsou určené
k použití během zákroku. Dodávají se sterilní v samostatném balení v
krabici s dodaným zařízením. Samostatné balíčky 6 sterilních zátek se
prodávají i po balíčcích 6 ks polyesterových zátek HAART.
Držák
HAART 200 se dodává na držáku, který lze připojit k rukojeti a ulehčit
tak polohování zařízení během zákroku (obrázek 2 na straně 9). Držák
Obsah
CZECK
1. Symboly značení na zařízení ...........................................................15
2. Zamýšlené použití ............................................................................15
3. Indikace pro použití ..........................................................................15
4. Popis zařízení k anuloplastice..........................................................15
4.1. Přehled ......................................................................................15
4.2. Technologické charakteristiky ...................................................15
4.3. Příslušenství..............................................................................16
5. Kontraindikace..................................................................................16
6. Varování...........................................................................................16
7. Bezpečnostní opatření......................................................................16
8. Bezpečnost vyšetření v systému magnetické rezonance (MR)........17
9. Potenciální nežádoucí příhody.........................................................17
10. Způsob dodání................................................................................17
10.1. Balení ......................................................................................17
10.2. Uskladnění...............................................................................17
11. Pokyny k použití .............................................................................18
11.1. Stanovení velikosti...................................................................18
11.2. Pokyny k manipulaci a přípravě...............................................18
11.3. Implantace zařízení .................................................................18
11.4 Sterilizace.................................................................................20
Odmítnutí záruk....................................................................................20
Patenty .................................................................................................20
DWG-01-023 Rev. C - ©2021 16
je vyroben z polyfenylsulfonu a k anuloplastickému zařízení je připojen
jedním stehem (obrázek 1). Zařízení lze z držáku vyjmout přeříznutím
stehu na jakémkoli místě podél čela držáku.
Obrázek 1. Zařízení k aortální anuloplastice
HAART 200 na držáku
Obrázek 2. Zařízení k aortální anuloplastice
HAART 200 a držák připojené k rukojeti
Obrázek 3. Souprava nástrojů HAART 201
sou polymerové materiály popraskané, natržené, nevykazují známky
strukturálního oslabení nebo jiné nečitelné známky. Rukojeť je nutné
před použitím a po ohnutí zkontrolovat, jestli není prasklá nebo nevyka-
zuje známky strukturálního oslabení. Nástroje s jakoukoli výše uvede-
nou vadou je nutné vyměnit, jelikož nemusí fungovat správně a mohly
by způsobit poranění pacienta. Další informace k těmto nástrojům
naleznete v návodu k použití soupravy nástrojů HAART 201.
5. Kontraindikace
•Zařízení je kontraindikováno u pacientů s porcelánovou aortou.
•Zařízení je kontraindikováno u pacientů s rozvíjející se bakteriální
endokarditidou.
•Zařízení je kontraindikováno u pacientů se silně kalcifikovanými
chlopněmi.
6. Varování
•Zařízení k aortální anuloplastice HAART 200 je určeno výhradně k
jednorázovému použití. Zařízení nepoužívejte opakovaně. Kromě
rizik uvedených v části komplikace může při opětovném použití dojít
k peroperačním komplikacím jako poškození zařízení, narušená
biokompatibilita zařízení a kontaminace zařízení. Opakované použití
může vést k infekci, závažné újmě na zdraví nebo úmrtí pacienta.
•Rozhodnutí použít zařízení k anuloplastice musí provést odpovědný
lékař dle individuálního posouzení zdravotního stavu pacienta v
kontextu rizik a výhod pro pacienta spojených s tímto postupem ve
srovnání s alternativní léčbou.
•Zařízení k anuloplastice se nepokoušejte deformovat ani tvarovat.
•Zařízení k aortální anuloplastice HAART 200 bylo sterilizováno
zářením gama. Dodává se sterilní ve dvojitém obalu. Ke sterilizaci
zařízení nebyl schválen žádný cyklus parní sterilizace.
•Pacienti po rekonstrukci chlopně, kteří mají podstoupit zubní nebo
jiné chirurgické zákroky, by měli dostat antibiotickou profylaxi,
aby se minimalizovalo riziko systémové bakterémie a protézové
endokarditidy.
•Stanovení správné velikosti zařízení k anuloplastice je důležitým
prvkem pro úspěšnou rekonstrukci chlopně. Významně menší velikost
chlopně může vést k její stenóze nebo dehiscenci prstence. Nadměrná
velikost může mít za následek regurgitaci chlopně. Velikost zařízení k
aortální anuloplastice HAART 200 se volí pomocí měřících pomůcek
dle zamýšleného použití zařízení. K výběru správné velikosti zařízení
používejte výhradně měřící pomůcky HAART v soupravě nástrojů
HAART 201. K měření velikosti nepoužívejte držák.
7. Bezpečnostní opatření
•Toto zařízení smí používat pouze chirurgové, kteří absolvovali školení
v technikách implantace zařízení HAART a technik měření velikosti.
•Rekonstrukce cípu aortální chlopně je rutinně vyžadována pro
vytvoření kompetence chlopně během opravy aortální chlopně.
Anuloplastika pomocí zařízení HAART by měla být zkombinována s
rekonstrukcí cípu, pokud je indikována.
•Komplexní léze cípů, včetně kalcifikací, fenestrací, perforací,
nodulárního zjizvení a retrakce, a tkáňové nedostatečnosti vyžadující
náplasťové materiály můžou být rizikovým faktorem pro selhání opravy.
•Zařízení nepoužívejte po uplynutí data spotřeby uvedeného na štítku.
•Zařízení je nutné skladovat ve vnější kartonové krabici, dokud
nebude připravené k umístění do sterilního pole, aby byla zajištěna
jeho sterilita a integrita. Nepoužívejte zařízení, které bylo vytaženo z
dvojitého obalu a upadlo, bylo znečištěno nebo jinak poškozeno.
•Nepoužívejte zařízen k aortální anuloplastice HAART 200, pokud došlo
k poškození nebo přerušení značeného uzávěru či uzávěr přímo chybí.
4.3. Příslušenství
Souprava nástrojů HAART 201 (obrázek 3) sestává ze dvou (2) ruko-
jetí, čtyř (4) měřících pomůcek a měřící koule. Rukojeti je vyrobena z
nerezové oceli ASTM A276, měřící pomůcky a měřící koule jsou vyro-
bené z polyfenylsulfonu.
Rukojeť lze našroubovat do měřících pomůcek a měřící koule. Rukojeť
lze také našroubovat do čela držáku a ulehčit si tak vyjmutí zařízení
z balení a polohování zařízení během zákroku (obrázek 2). Rukojeť
lze ohnout v zúžené části a zavést tak měřící pomůcky, měřící kouli a
zařízení do operačního pole požadovaným způsobem.
Varování: Měřící pomůcky, měřící koule a rukojeť jsou určené k opako-
vanému použití. Před každým použitím je však nutné je zkontrolovat, jestli
nejsou poškozené. Tyto opakovaně použitelné nástroje byly schválené k
čištění a parní sterilizaci zajišťované nemocnicí. Před každým použitím
je nutné měřící pomůcky a měřící kouli vizuálně zkontrolovat, jestli nej-

DWG-01-023 Rev. C - ©2021 17
•Zařízení likvidujte jako nebezpečný biologický odpad.
•Při implantaci nepoužívejte jehly s řeznými okraji, abyste nepoškodili
látku pokrývající zařízení.
•Implantační stehy by měly být umístěny hluboko, aby zařízení HAART
byla umístěna nejméně 2 mm pod aortální junkcí cípu a vrcholky
subkomisurálních trojúhelníků, a tím se zabránilo kontaktu mezi cípy
a zařízením.
•Aby se zabránilo protahování stehů nativní prstencovou tkání, měli
byste na stehy použít zátky dle pokynů k použití. K eliminování mezer
mezi zařízením a přilehlými prstencovými tkáněmi a k udržení tahu
spojeného s anulární redukcí použijte dostatečný počet širokých
horizontálních matracových stehů.
•Stehy by měly být pevně utaženy a zavázány, aby zařízení bylo v
dobrém kontaktu s přilehlými prstencovými tkáněmi. Konečky šicího
materiálu je nutné přivázat k laterální části anulárních zátek dle
popisu v části Pokyny k použití, aby nepoškodily cípy. Přebývající šicí
materiál je nutné co nejvíce zkrátit.
•Při použití pooperační antikoagulace je nutné zajistit pečlivé sledování
antikoagulačního stavu pacienta. Chirurgové používající zařízení k
aortální anuloplastice HAART 200 musí znát nejnovější doporučení
k antikoagulačním režimům.
8. Bezpečnost vyšetření v systému magnetické
rezonance (MR)
Podmíněně kompatibilní s prostředím MR
Neklinické testování prokázalo, že zařízení k aortální anuloplastice
HAART 200 je podmíněně kompatibilní s prostředím MR. Pacient s
tímto zařízením může bezpečně podstoupit vyšetření na systému MR za
následujících podmínek:
•Statické magnetické pole o intenzitě 1,5 tesla a 3 tesla
•Maximální prostorový gradient pole 4000 G/cm (40 T/m)
•Maximální celotělová průměrná specifická míra absorpce (SAR)
uváděná systémem MR 4,0 W/kg (řízený provozní režim první úrovně)
při 3 T
Zahřívání v důsledku vysokofrekvenčního pole
Za výše definovaných podmínek snímání se na zařízení k aortální anu-
loplastice HAART 200 očekává maximální teplotní nárůst nižší než 3,0
°C po 15 minutách kontinuálního snímání.
Upozornění: Chování při RF zahřívání není přímo úměrné síle stat-
ického pole. Zařízení, u nichž nedochází k detekovatelnému zahřívání
při jedné síle pole, mohou vykazovat vysoké hodnoty lokalizovaného
zahřívání při jiné síle pole.
Artefakt na MR
V neklinickém testování zasahoval obrazový artefakt způsobený zařízením
přibližně 10 mm od zařízení k aortální anuloplastice HAART 200 při zobra-
zení v gradientní pulzní echo sekvenci na systému MR o intenzitě 3 T.
9. Potenciální nežádoucí příhody
Všechny potenciální pacienty je nutné před zákrokem informovat o
výhodách a rizicích spojených s rekonstrukcí chlopně a anuloplastikou.
U jakéhokoli otevřeného zákroku na srdci, včetně implantace zařízení
k aortální anuloplastice HAART 200, hrozí závažné komplikace včetně
úmrtí. Tyto potenciální komplikace zahrnují problémy obecně spojené s
otevřeným zákrokem na srdci a použitím celkové anestezie. Potenciální
komplikace spojené se zařízením k aortální anuloplastice HAART 200 a
jeho implantací jsou uvedené v tabulce 1.
Tabulka 1. Možné komplikace spojené se zařízením/zákrokem
Abraze přírodní chlopně Poškození cípu
Alergická reakce Obstrukce výtokového traktu levé
komory
Angina pectoris Infarkt myokardu
Aortální insucience Neurologické příhody
(včetně TIA, mrtvice a
psychomotorického decitu)
Arytmie Bolest (diskomfort pacienta)
Atrioventrikulární blokáda Perikardiální výpotek
Úmrtí Trvalý kardiostimulátor
Explantace zařízení Pleurální výpotek
Zlomení zařízení Psychologické problémy
Migrace zařízení nebo nesprávná
poloha vyžadující intervenci
Renální insucience / selhání
Endokarditida Reoperace
Prodloužení zákroku nebo jeho
přerušení
Poruchy respiračního systému
Horečka Dehiscence prstence
Gastrointestinální poruchy Stenóza
Srdeční vada Poranění koronárních artérií
šicím materiálem
Hematom Synkopa
Hemolýza nebo hemolytická
anémie
Trombóza nebo tromboembolie
Krvácení Toxická reakce
Hypertenze Problémy s hojením ran
Infekce – místní, bakterémie,
sepse
10. Způsob dodání
10.1. Balení
Zařízení k aortální anuloplastice HAART 200 je k dispozici ve
velikostech 19, 21, 23 a 25 mm. Každé balení v krabici se zařízením
k aortální anuloplastice HAART 200 obsahuje zátky a jednu soupravu
zařízení k anuloplastice sestávající ze zařízení zajištěného šicím
materiálem k příslušnému držáku. Sestavené zařízení a držák jsou
balené ve stohovaných uzavřených nosičích. Zátky jsou balené
samostatně ve stohovaných kapsách. Balící systém ulehčuje vložení
zařízení do sterilního pole. Součásti v balení jsou sterilní, pokud jsou
kapsy, nosiče a víka nepoškozené a neotevřené. Povrchy vnějšího
obalu jsou NESTERILNÍ a nesmí se vkládat do sterilního pole.
10.2. Uskladnění
Produkt skladujte v původním obalu, včetně vnější krabice, na čistém,
suchém místě, aby byl produkt chráněn a minimalizovalo se riziko
kontaminace. Doporučujeme pravidelně obměňovat sklad, aby bylo
zajištěno použití před uplynutím data spotřeby vytištěného na štítcích
na krabici. Zařízení nepoužívejte po uplynutí data spotřeby uvedeného
na štítku.

DWG-01-023 Rev. C - ©2021 18
11. Pokyny k použití
11.1. Stanovení velikosti
Velikost zařízení k aortální anuloplastice HAART 200 je třeba zvolit na
základě délky nefúzovaného okraje cípu chlopně. Délka volného okraje
se stanovuje pomocí měřících pomůcek, které jsou součásti soupravy
nástrojů HAART 201. Měřící pomůcky se dodávají s průměry 19, 21, 23 a
25 mm odpovídající čtyřem velikostem zařízení k aortální anuloplastice
HAART 200.
Stanovení správné velikosti zařízení k anuloplastice je důležitým prvkem
pro úspěšnou rekonstrukci chlopně. Správná velikost zařízení k aor-
tální anuloplastice HAART 200 se stanovuje následovně: našroubu-
jte jednotlivé měřící pomůcky na rukojeť a zaveďte je za nefúzovaný
cíp chlopně, aby délka volného okraje cípu mezi komisurálními úpony
ležela hladce podél obvodu měřící pomůcky. Správná měřící pomůcka
pro daný prstenec bude mít vzdálenost od jedné tečkované oblasti k
druhé odpovídající délce volného okraje cípu od jedné komisuře k
druhé (obrázek 4). Pokud leží délka volného okraje cípu mezi dvěma
velikostmi, zvolte menší z možností. Číslo velikosti na příslušné měřící
pomůcce (dle měřeného cípu) odpovídá příslušné velikosti zařízení.
Obrázek 4. Stanovení správné délky volného okraje
cípu měřící pomůckou
Abyste potvrdili velikost zařízení vybraného pomocí měřící pomůcky,
lze změřit vzdálenost mezi komisurami chlopně pomocí měřící pomůcky
na chlopeň, jako je například Hegarův dilatátor. Cílem tohoto měření
je zajistit, aby průměr zařízení vybraného pomocí měřících pomůcek
HAART 201 nevedl k nadměrnému snížení vzdálenosti mezi komisur-
ami.
11.2. Pokyny k manipulaci a přípravě
Všechna zařízení se dodávají připojená k držáku, balená ve stohovaných
uzavřených nosičích ulehčujících přenos zařízení do sterilního pole.
Zátky jsou balené ve stohovaných kapsách. Vnitřní kapsy a uzavřené
nosiče je třeba před otevřením zkontrolovat, jestli nejsou poškozené.
Nepoužívejte zařízení, pokud je narušen sterilní obal.
Držák je třeba připojit k rukojeti obsažené v soupravě nástrojů HAART
201 a ulehčit tak vyjmutí zařízení z obalu a implantaci zařízení do kořene
aorty.
11.3. Implantace zařízení
Fixace kolíčků stehy
Implantace začíná fixací dvou kolíčků zařízení pomocí stehů ke dvěma
subkomisurálním oblastem v konfiguracích podobných typu „Cabrol“ s
hlubokým zavedením polypropylenových horizontálních matracových
stehů 4-0 podporovaných zátkami nad anulem do aortální stěny (obrázek
5). K fixaci kolíčků doporučujeme použít polypropylenový šicí materiál,
ulehčíte si tak utahování stehů a zasunutí zařízení pod chlopeň.
Obrázek 5. Šicí technika pro kolíčky zařízení
k aortální anuloplastice HAART 200
2mm
Obrázek 6. Naložení stehů na kolíčky
Při navazování stehů na kolíčky se zařízení k aortální anuloplastice
HAART 200 nachází na držáku nad chlopní (obrázek 6). Stehy na kolíčky
je třeba umístit tak, aby hroty kolíčků zařízení byly umístěny nejméně 2
mm pod subkomisurálním prostorem.
Zařízení k aortální anuloplastice HAART 200 je pokryto polyestero-
vou látkou podporující endotelizaci. Horizontální matracové stehy na
kolíčcích slouží primárně ke korekci polohy zařízení před uložením dalších
smyčkových stehů kolem cípových částí zařízení. Pouze horizontální
matracové stehy na kolíčcích by měly zachytávat látku, a to výhradně
na vnitřní straně kolíčků (obrázek 5). V těchto oblastech je přidáno větší
množství látky umožňující průchod jehly, provádějte však pouze velice
povrchové vpichy.
Po umístění dvou stehů na kolíčcích posuňte zařízení pod nativní chlopeň
a protněte šicí materiál spojující zařízení k držáku. Jemně odpojte zařízení
k aortální anuloplastice HAART 200 od držáku – primárně sesouvejte
zařízení z držáku tlakem v blízkosti středu každé cípové části zařízení.
Až po vysunutí zařízení z držáku můžete držák vytáhnout zpod chlopně.
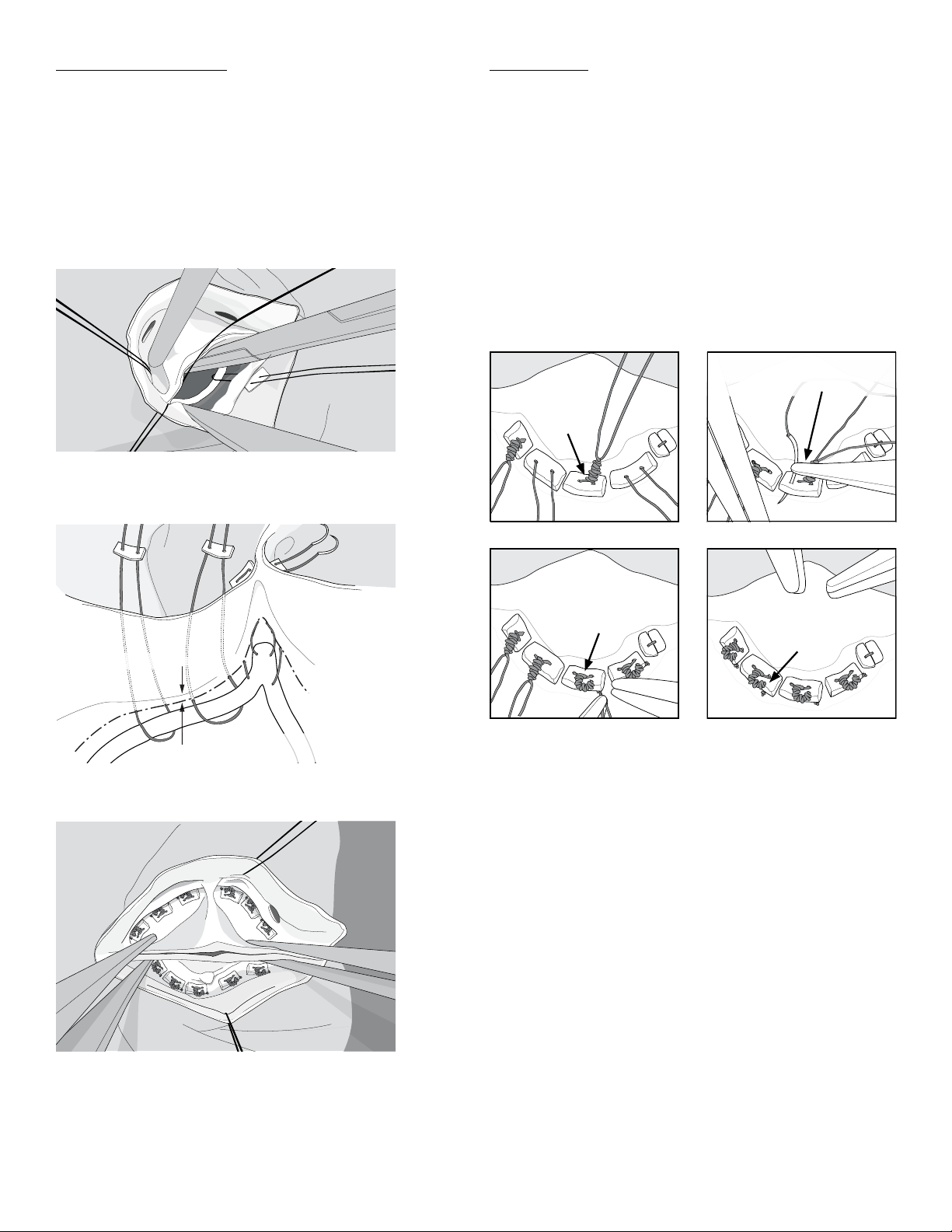
DWG-01-023 Rev. C - ©2021 19
Stehy v sinových částech
Kolem zařízení naložte dva smyčkové stehy v sinových částech, směřu-
jte je nahoru přes anulus, opět s hlubokým zavedením do aorty, a
vyveďte je nad chlopní do jemné zátky (obrázky 7 a 8). Doporučujeme
použít polypropylenový šicí materiál 4-0, aby bylo možné komplexní
horizontální matracové stehy na koncích pevně utáhnout. Tři smyčkové
stehy budou umístěny kolem nefúzované sinové části zařízení a čtyři
(4) smyčkové stehy budou umístěny kolem sinové části, která odpovídá
fúzovanému cípu, dva na každém švu (obrázek 9).
2mm
Obrázek 7. Smyčkové stehy na cípové části
Obrázek 8. Přišití cípových částí se zařízením
ležícím pod cípy chlopně.
Obrázek 9. Konečná konfigurace stehů.
Ošetření stehů
Po naložení všech devíti stehů je třeba každý z nich pevně utáhnout
přes zátku do 8 uzlů. Ujistěte se, že jsou kolíčky cípů zatlačené do sub-
komisurálních oblastí a že látka zařízení leží pod tkání cípů. Uzly je třeba
pečlivě utáhnout, aby se stehy neuvolnily.
Dlouhé konečky šicího materiálu na prstenci v koronárním sinu můžou
vést k poranění cípů. Posledním krokem nakládání stehů na prstenec je
zavedení jedné nebo obou jehel utaženého anulárního stehu směrem
dolů přes střed laterální strany zátky a opětovné utažení šicího materiálu
k zátce dalšími 6 uzly. Díky tomuto manévru budou konečky šicího
materiálu nasměrované dolů směrem od cípů.
Obrázek 10 znázorňuje postup správného ošetření konečků šicího
materiálu.
Konečky šicího
materiálu a uzly zakryté
pod zátkami
DC
Opětovně utažený
a zkrácený steh
Jehla zavedená přes
laterální zátku
BA
Prstenec
Cíp
Steh utažený
8 uzly
Obrázek 10. Ošetření anulárních stehů
Panel A: Horizontální polypropylenové matracové stehy držící zařízení
pevně pod prstencem vystupují nad prstencem a jsou podporované
jemnými polyesterovými zátkami. Stehy jsou pevně utaženy 8 uzly přes
zátky (šipky). Tyto stehové linie významně zmenšují velikost prstence a
z toho důvodu můžou být vystavené značnému tahu. Při vytváření 8 uzlů
postupujte tudíž velice pečlivě, aby se neuvolnily.
Panel B: Každý steh je veden směrem dolů přes laterální zátku (šipka)
a opět utažen 6 uzly. Tento krok umísťuje konečný uzel a konečky šicího
materiálu laterálně a pod zátku.
Panel C: Konečky šicího materiálu jsou pod zátkami co nejvíce zkrá-
ceny (šipka).
Panel D: Dvojitý uzel brání uvolnění jednotlivých stehů. Jelikož se druhý
uzel nachází pod zátkou, konečky šicího materiálu směřují laterálně a
dolů do anulu, aby nedocházelo ke kontaktu s cípy.
Na konci implantace zařízení musí chirurg všechny anulární stehy
pečlivě zkontrolovat. Pokud bude mít jakékoli pochyby týkající se polohy
daného konečku šicího materiálu, je nutné sérii uzlů pomocí jemného
šicího materiálu 6-0 Prolene opět zafixovat směrem dolů pryč od cípu.
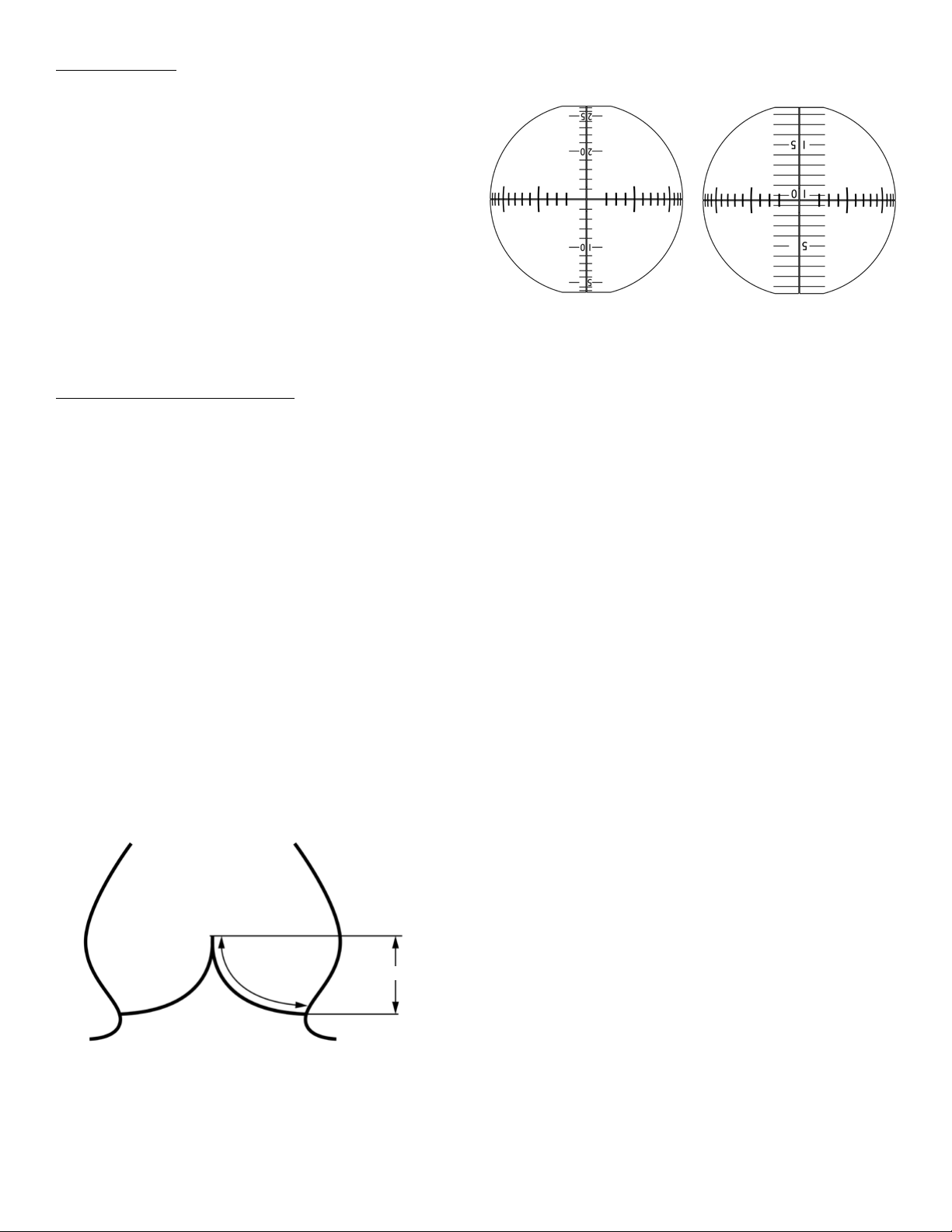
DWG-01-023 Rev. C - ©2021 20
Obrázek 12. Škála k měření délky cípů (vlevo) a škála k měření
efektivní výšky (vpravo)
Rekonstrukce cípu
Pokud je indikována, měla by být rekonstrukce cípu provedena po zave-
dení zařízení k anuloplastice a podle etablovaných technik rekonstrukce
aortálního cípu. Zavedení zařízení k anuloplastice posune prstenec a
cípy směrem ke středu chlopně, ale stále může být přítomný výrazný
prolaps cípu. Prolaps cípu může být korigován plikačními stehy na vol-
ném okraji cípu nebo uzavřením rozštěpu chlopně typu 1. Pokud jsou
přítomny, je třeba strukturální defekty cípů korigovat perikardiální rekon-
strukcí nebo jinými metodami dle školení a preferencí chirurga. Cílem je
dosáhnout stejné délky obou cípů a stejné efektivní výšky > 8 mm.
Settepani F, Cappai A, Raffa G, et al. Cusp repair during aortic
valve-sparing operation: technical aspects and impact on results. J
Cardiovasc Med (Hagerstown). 2015 Apr;16(4):310-7.
Mazzitelli D, Stamm C, Rankin JS, et al. Leaflet reconstructive
techniques for aortic valve repair. Ann Thorac Surg. 2014
Dec;98(6):2053-60.
Vyhodnocení rekonstrukce chlopně
Po implantaci zařízení a rekonstrukci cípů by se měla provést kontrola
cípů a aorta na komisurách by měla být lateriálně roztažena, aby se
posoudila relativní délka a výška cípů. Oba cípy by měly mít stejnou
délku a vertikálně by měly mít správnou efektivní výšku a povrch srůstu.
Cípy by se měly setkávat ve středové čáře bez známek centrálních
mezer nebo prolapsu cípů. Nakonec by měly být cípy doširoka otevřeny,
aby se vytvořil dostatečný otvor.
Efektivní výšku a geometrickou výšku lze vyhodnotit pomocí měřící
koule dodávané jako součást soupravy nástrojů HAART 201 (obrázek
11). Měřící koule má na svém povrchu vyznačené dvě různé vertikální
škály. Jedna škála začíná u vrcholu koule a slouží k odhadu vertikální
efektivní výšky cípu chlopně od základny cípu k volnému okraji (obrázek
12). Po úspěšné rekonstrukci by měla být efektivní výška cípu přibližně
8 až 10 mm. Při opětovném zatlačení měřící koule směrem dolů do kom-
plexu cípů a sinu bude po úspěšné rekonstrukci volný okraj cípu ležet na
úrovni rovníku měřící koule. Pomocí druhé škály lze v případě potřeby
vyhodnotit geometrické délky cípu, postup slouží k dalšímu vyhodno-
cení velikosti a symetrie cípu po jeho celkové rekonstrukci.
Obrázek 11. Diagram geometrické výšky a efektivní výšky cípu
Efektivní výška
11.4 Sterilizace
Zařízení k aortální anuloplastice HAART 200 se dodává sterilní na
držáku. Resterilizace je zakázána. Poškozená nebo kontaminovaná
zařízení je zakázané používat opakovaně. Zátky se dodávají sterilní a je
zakázáno je resterilizovat. Poškozené zátky nebo zátky kontaminované
kontaktem s tělem pacienta je zakázané používat opakovaně.
Odmítnutí záruk
I když bylo zařízení k aortální anuloplastice HAART 200 a souprava
nástrojů HAART 201, v dalším textu označované jako „produkt“, vyro-
bené za pečlivě kontrolovaných podmínek, společnost BioStable Sci-
ence & Engineering nemůže ovlivnit podmínky, za kterých bude pro-
dukt použit. Společnost BioStable Science & Engineering a její dceřiné
společnosti (spolu „BioStable“) tudíž odmítá jakékoli záruky, vyjádřené
i implikované, týkající se produktu, včetně mimo jiné jakékoli impliko-
vané záruky prodejnosti či vhodnosti pro určitý účel. Společnost Bio-
Stable neponese vůči žádné osobě či subjektu odpovědnost za jakékoli
zdravotní náklady či přímé, náhodné nebo následné škody způsobené
použitím, vadou, selháním či poruchou produktu, bez ohledu na to, jestli
je reklamace takových škod provedena na základě záruky, smlouvy,
občanskoprávní odpovědnosti či jinak. Žádný subjekt nemá oprávnění
společnost BioStable zavázat k jakýmkoli povinnostem či zárukám vzta-
hujícím se k tomuto produktu.
Výjimky a omezení výše uvedeného nejsou zamýšlené a nelze je považo-
vat za porušení povinností vyplývajících z platných zákonů. Pokud je
jakákoli část nebo podmínky tohoto Odmítnutí záruk nebo Omezení zod-
povědnosti považovaná jakýmkoli soudem v kompetentní jurisdikci za
nezákonnou, nevynutitelnou nebo v rozporu s platnými zákony, platnost
zbývající části tohoto Odmítnutí záruk a Omezení zodpovědnosti nebude
narušena. Veškerá práva a povinnosti budou definovány a vymáhány,
jako kdyby Odmítnutí záruk a Omezení zodpovědnosti neobsahovali
danou část nebo podmínku považovanou za neplatnou.
Patenty
Patenty: US8,163,011; US8,425,594; US9,161,835; US9,814,574;
US9,844,434; US10,130,462; US10,327,891; CA 2,665,626; JP5881653;
JP5877205; JP6006218; EP2621407; EP2621408 a u dalších přihlášek
probíhají příslušná řízení.
Délka cípu
Table of contents
Languages:
Other BioStable Medical Equipment manuals
Popular Medical Equipment manuals by other brands

Getinge
Getinge Arjohuntleigh Nimbus 3 Professional Instructions for use

Mettler Electronics
Mettler Electronics Sonicator 730 Maintenance manual

Pressalit Care
Pressalit Care R1100 Mounting instruction

Denas MS
Denas MS DENAS-T operating manual

bort medical
bort medical ActiveColor quick guide

AccuVein
AccuVein AV400 user manual













