PI008/CE v011.00/2019-04-30
Page 5 of 9
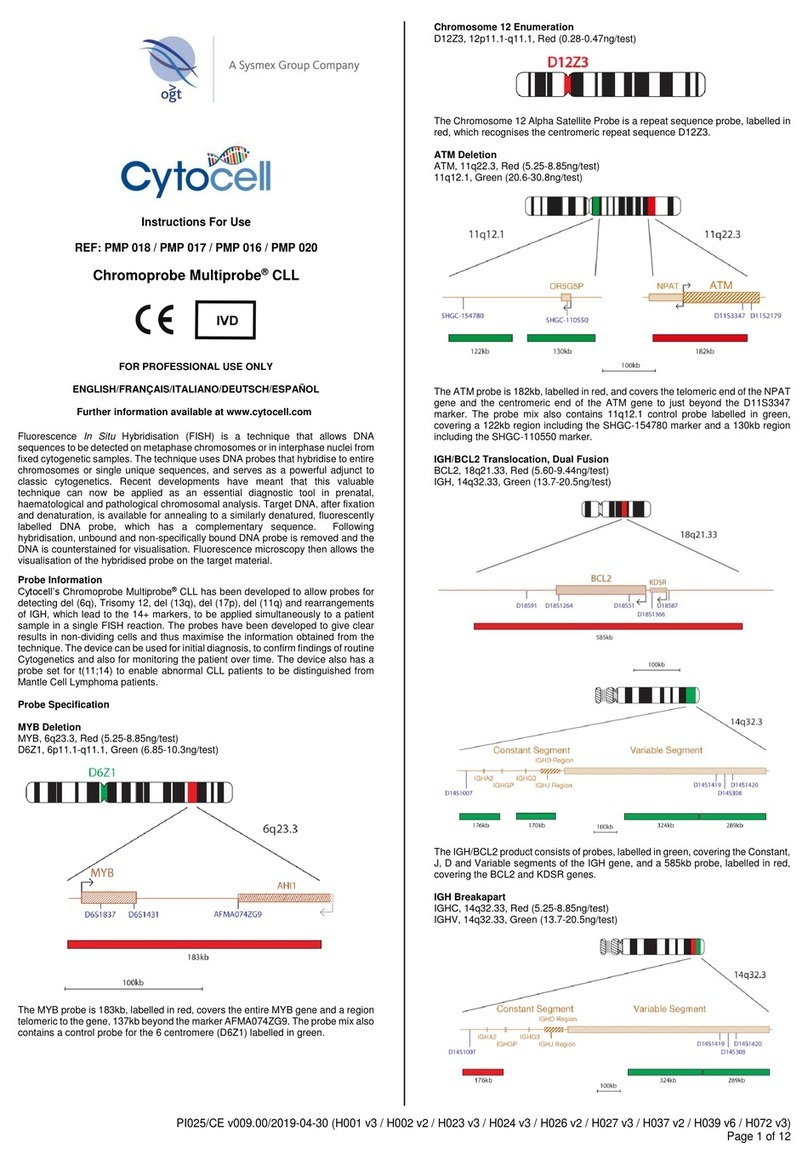
9. Olio per lenti ad immersione del microscopio a fluorescenza.
10. Centrifuga da banco
11. .Vetrini coprioggetto per microscopio a fluorescenza (24 x 50 mm)
12. Timer.
13. Bagnomaria a 37ºC senza agitatore.
Configurazione ottimale del microscopio e dei filtri
Per una visualizzazione ottimale, utilizzare una lampada al mercurio da 100-W e obiettivi
apocromatici piani di tipo x63 o x100. Per una visualizzazione ottimale e simultanea dei
fluorofori rossi e verdi e DAPI, utilizzare un filtro passa banda triplo DAPI/FITC/Texas Red. Il
fluoroforo dell’acqua ha una specificità allo spettro Aqua e DEAC (è richiesto un filtro passa
banda singolo Aqua o DEAC).
Prima dell’uso, verificare il corretto funzionamento del microscopio a fluorescenza. Utilizzare
olio da immersione adatto per microscopia a fluorescenza e formulato per bassa auto-
fluorescenza. Evitare di mischiare la soluzione DAPI Antifade con l’olio da immersione per
microscopio poiché questo oscura i segnali. Seguire le raccomandazioni dei produttori relative
alla durata della lampada e all’età dei filtri.
Preparazione del campione
Il Chromoprobe Multiprobe® OctoChrome™- è destinatoall’uso su cellule di sangue periferico
in coltura fissate con fissativo di Carnoy da preparare seguendo le linee guida del laboratorio
o dell’istituzione.
Preparare i campioni asciugati all’aria sui vetrini a stampo del Chromoprobe Multiprobe®
Cytocell in conformità con il protocollo Cytocell riportato qui sotto. Si sconsiglia di essiccare a
caldo o processare altrimenti i vetrini in quanto si potrebbe ridurre la fluorescenza del segnale.
Protocollo Chromoprobe Multiprobe®
N.B.: le sonde utilizzate con il dispositivo Chromoprobe Multiprobe®sono marcate
direttamente con fluorofori, che sono sensibili alla luce. Verificare che in ogni fase venga
limitata l’esposizione delle sonde alle luci del laboratorio (non è necessario lavorare al buio).
1. Preparazione del vetrino
a) Pulire un vetrino a stampo. Immergerlo per 2 minuti in metanolo al 100% e asciugarlo
minuziosamente con un panno morbido pulito.
b) Determinare l’indice mitotico corretto. È importante che i campioni designati abbiano un
indice mitotico sufficientemente alto da consentire la rilevazione della anomalie
cromosomiche. Per verificare la densità del campione, pipettare con una micropipetta
(es. una Gilson P10 o P20) 4µl della sospensione cellulare su una delle aree del vetrino
a stampo vuoto e lasciare asciugare all'aria. Vista l’entità minima del volume utilizzato,
di solito per trasferire la sospensione sarà necessario toccare delicatamente il vetrino
con la punta della pipetta. Esaminare al microscopio a contrasto di fase. Se la densità
cellulare è troppo elevata, diluire la sospensione con dell’altro fissativo. Se l’indice
mitotico è troppo basso, centrifugare a bassa velocità la sospensione cellulare fissata a
160g per 10 minuti. Osservare il volume del surnatante, rimuoverlo e risospendere il
pellet cellulare in un volume inferiore di fissativo. Se la densità del campione cellulare è
stata modificata, trasferire 4µl del campione concentrato in un altro riquadro del vetrino
per il test e riesaminarlo al microscopio a contrasto di fase.
N.B.: 50 µl è il volume minimo necessario per il protocollo.
c) Controllo della qualità dei campioni. Si deve verificare l’eventuale presenza di citoplasma
nei campioni, che interferirebbe con il protocollo in situ. Se all’osservazione al
microscopio a contrasto di fase i cromosomi appaiono circondati da materiale granulare,
i risultati del test saranno compromessi. Un metodo per ridurre la presenza di citoplasma
è trasferire 4µl del campione sul vetrino a stampo e osservare la propagazione del
fissativo. In condizioni normali, il fissativo raggiunge un’espansione massima, si ritira e
quindi evapora. Per ripulire efficacemente il campione da eventuali tracce di citoplasma,
un sistema efficace consiste nel lasciare cadere una goccia di fissativo sul campione nel
momento in cui il fissativo in espansione ha raggiunto il suo massimo. Lasciare
evaporare la goccia di fissativo e riesaminare il campione.
d) Trasferimento sul vetrino. Pipettare 4µl di sospensione cellulare su tutte le 8 aree del
vetrino a stampo procedendo su riquadri alternati come indicato qui sotto. Così facendo
si eviterà che l’espansione delle cellule provochi interferenze reciproche.
e) Una volta che la prima serie di gocce si è asciugata all’aria, trasferire gocce da 4µl nei
riquadri ancora vuoti, con la stessa modalità. Dopo che il vetrino si è asciugato,
osservandolo al microscopio a contrasto di fase si potrà verificare se tutti i riquadri sono
stati riempiti. Se così non fosse, o se qualche riquadro contenesse un numero
insufficiente di cellule, basterà ripetere il trasferimento su questi riquadri: non è
necessario ripetere il trasferimento su un altro vetrino. Se esaminando il vetrino si
notasse un riquadro con un numero insufficiente di cellule o di metafasi, aggiungere
una o più gocce di sospensione per aumentare la densità cellulare.
N.B.: se le metafasi appaiono troppo diffuse, pulire accuratamente un nuovo vetrino astampo
in metanolo ed effettuare un nuovo trasferimento facendo asciugare ogni goccia prima di
procedere con la successiva.
2. Preparazione del dispositivo Chromoprobe Multiprobe®e del vetrino a stampo
a) Accertarsi che la Camera di ibridizzazione Chromoprobe Multiprobe®sia nel bagnomaria
a 37ºC e lasciare che si equilibri a 37ºC (+/- 1ºC). Se il bagnomaria è stato acceso con
acqua fredda potrebbe essere necessaria anche un'ora.
b) Miscelare la soluzione di ibridizzazione pipettando ripetutamente e preriscaldare a 37ºC
un'aliquota da 25µl per dispositivo. Pre-riscaldare inoltre ogni dispositivo ponendolo su
una piastra a 37ºC con l'etichetta rivolta verso il basso. Non toccare le superfici in rilievo
del dispositivo.
c) Immergere i vetrini a stampo contenenti i campioni fissati in 2xSSC per 2 minuti a
temperatura ambiente (TA) senza agitare.
d) Mentre il dispositivo è ancora a 37ºC, disidratare i vetrini a stampo contenenti i campioni
fissati con diluizioni di etanolo in serie (70%, 85% e 100%, 2 minuti ciascuno) a TA,
asciugare all’aria e riscaldare su una piastra a 37ºC.
e) Aggiungere, con una micropipetta P10, 2µl di soluzione di ibridizzazione preriscaldata a
ognuna delle 8 aree presenti sul dispositivo preriscaldato, mentre è ancora sulla piastra
a 37ºC.
3. Posizionamento del vetrino a stampo sul dispositivo
a) Capovolgere con cura il vetrino a stampo sul dispositivo in modo che il numero 1, che
ora è a testa in giù, si trovi sopra l'area in alto a destra del dispositivo Per facilitare la
localizzazione del riquadro numero 1 (Cromosomi 3, 15 & 17), la sua posizione sul
dispositivo è stato contrassegnato con un punto arancione).
b) Verificare il preciso allineamento del vetrino a stampo con le corrispondenti aree del
dispositivo. Abbassare con cura il vetrino sul dispositivo in modo che le gocce di
soluzione di ibridizzazione entrino in contatto con il vetrino. Applicare una pressione
leggera ed uniforme per fare sì che la soluzione di ibridizzazione diffonda fino ai margini
di ciascuna delle aree in rilievo del dispositivo.
c) Sollevare con cura il vetrino tenendolo per l'estremità smerigliata e capovolgerlo in modo
che il vetrino stesso si trovi al di sotto del dispositivo. Accertarsi che il dispositivo non
strisci lungo il vetrino a stampo, causando la contaminazione crociata delle sonde.
d) Porre su una piastra o un incubatore a 37ºC (+/- 1ºC) per 10 minuti.
4. Istruzioni per l’uso del termometro di superficie per vetrini Cytocell
a) Prima di procedere alla denaturazione, con il termometro di superficie per vetrini Cytocell
controllare che la temperatura della piastra sia di 75ºC.
b) Per utilizzare il termometro in modo appropriato, posizionarlo sulla superficie della piastra
e attendere che i diversi segmenti smettano di cambiare colore. La temperatura effettiva
è indicata da un colore turchese intenso.
N.B.:
c) Quando i segmenti hanno un aspetto granulare ed i colori non sono più uniformi e
regolari, il termometro deve essere eliminato perché esaurito. La durata di ogni
termometro, tuttavia, dovrebbe essere sufficiente per un kit da 10 dispositivi.
d) Il termometro è un dispositivo a cristalli liquidi e, benché riutilizzabile, deve essere trattato
con cura per garantire una durata adeguata. Il termometro deve essere utilizzato solo
per controllare la temperatura delle piastre, non per effettuare il monitoraggio delle loro
prestazioni nel tempo.
5. Denaturazione
N.B.: per questa procedura NON è possibile utilizzare un blocco riscaldante del
termociclatore per la PCR al posto di una piastra solida.
a) Trasferire sulla piastra l’insieme vetrino/dispositivo facendo molta attenzione a tenerlo in
posizione orizzontale. Verificare che il vetrino con i campioni sia bene a contatto con la
piastra.
b) Denaturare sulla piastra a 75ºC (+/- 1ºC) per 5 minuti.
6. Ibridizzazione
Porre l’insieme vetrino/dispositivo nella camera di ibridizzazione Chromoprobe Multiprobe®
preriscaldata, riposizionare il coperchio e far flottare la camera nel bagnomaria a 37ºC
(+/- 1ºC) (senza agitazione) per tutta la notte.
N.B.:
a) Non sigillare il coperchio sulla camera di ibridizzazione.
b) Non chiudere il bagnomaria con un coperchio.
c) Non effettuare l’ibridizzazione in un incubatore.
d) Accertarsi che la camera di ibridizzazione sia completamente asciutta (cioè che
all'interno della camera non vi siano acqua o panni umidi).
Il livello di umidità all'interno della camera è essenziale per una ibridizzazione
ottimale. Per ottenere i livelli corretti procedere come indicato qui sotto.
7. Lavaggi stringenti post-ibridizzazione
N.B.: non sottoporre alla procedura dei lavaggi stringenti più di due vetrini per volta.
a) Rimuovere con cura il dispositivo dal vetrino.
b) Immergere il vetrino in 0,4xSCC (pH 7,0) a 72ºC (+/- 1ºC) per 2 minuti senza agitare.
c) Fare sgocciolare il vetrino e immergerlo in 2xSCC, 0,05% Tween-20 a TA (pH 7,0) per
30 secondi senza agitare.
8. Montaggio e visualizzazione dei risultati
a) Fare sgocciolare il vetrino e applicare a ogni estremità 20µl di antifade DAPI.
b) Coprire con un coprioggetto (24 x 50mm), rimuovere eventuali bolle e lasciare che il
colore si sviluppi al buio per 10 minuti.
c) Osservare con un microscopio a fluorescenza.
N.B.: alcuni microscopi hanno un supporto per vetrini che rende difficile visualizzare le
estremità del vetrino stesso. In questo caso è sufficiente ruotare il vetrino di 180per
agevolarne la visualizzazione.
Stabilità del vetrino finito
I vetrini FISH restano analizzabili per circa 1 mese se conservati al buio a temperatura
ambiente o inferiore.
Raccomandazioni per l'uso
1. La cottura o l’invecchiamento dei vetrini potrebbe ridurre la fluorescenza del segnale.
2. Le condizioni di ibridazione potrebbero essere influenzate negativamente dall’uso di
reagenti diversi da quelli forniti o raccomandati da Cytocell Ltd.
3. Usare un termometro calibrato per misurare la temperatura delle soluzioni, dell’acqua
e degli incubatori, poiché queste temperature sono fondamentali per ottimizzare le
prestazioni del prodotto.
4. Le concentrazioni, il pH e la temperatura del lavaggio sono importanti, in quanto una
stringenza bassa potrebbe causare un legame non specifico della sonda, mentre una
stringenza troppo elevata potrebbe causare un’assenza di segnale.
5. La denaturazione incompleta può causare un’assenza di segnale, mentre anche una
denaturazione eccessiva può causare un legame non specifico.
6. Un eccesso di ibridazione può causare segnali aggiuntivi o imprevisti.
7. Gli utenti sono tenuti a ottimizzare il protocollo a seconda dei loro campioni, prima di
utilizzare il test per finalità diagnostiche.
8. I vetrini devono essere valutati indipendentemente da due analisti.
9. In caso di legami non specifici potrebbero verificarsi delle condizioni non ottimali, che
potrebbero essere erroneamente interpretate come segnali della sonda.
Risultati attesi
1. Le sonde painting per cromosomi acrocentrici contengono materiale del braccio corto.
Tale materiale è condiviso dai cromosomi dei gruppi D e G, per cui in queste regioni si
può osservare un’ibridizzazione crociata.
2. La sonda painting per cromosoma intero per il cromosoma 16 può mostrare una lieve
ibridizzazione crociata con le regioni eterocromatiche del cromosoma Y.
3. La sonda painting per il cromosoma Y contiene le regioni pseudoautosomiali in comune
con il cromosoma X, perciò in queste regioni si può osservare un’ibridizzazione crociata.
4. I cromosomi 1, 5 e 19 hanno sequenze in comune del DNA centromerico, perciò in
queste regioni si possono osservare ibridizzazioni crociate tra questi cromosomi.
5. La sonda painting per cromosoma intero per il cromosoma 1 può mostrare un segnale
più luminoso in 1p36.
6. Le sonde painting per cromosoma intero non coprono i blocchi eterocromatici nei
cromosomi 1, 9 e 16.