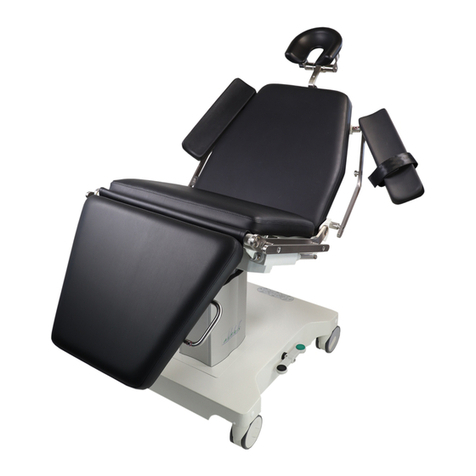
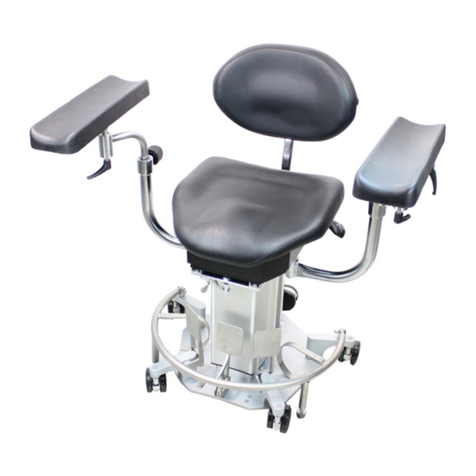
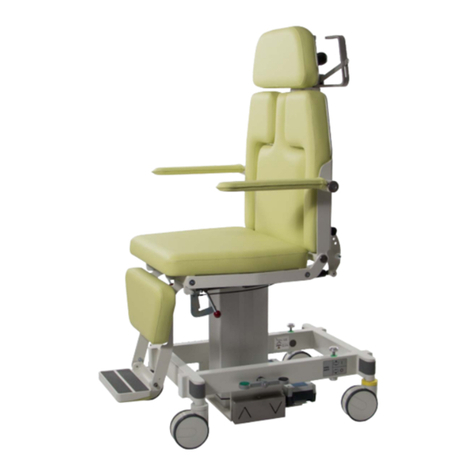
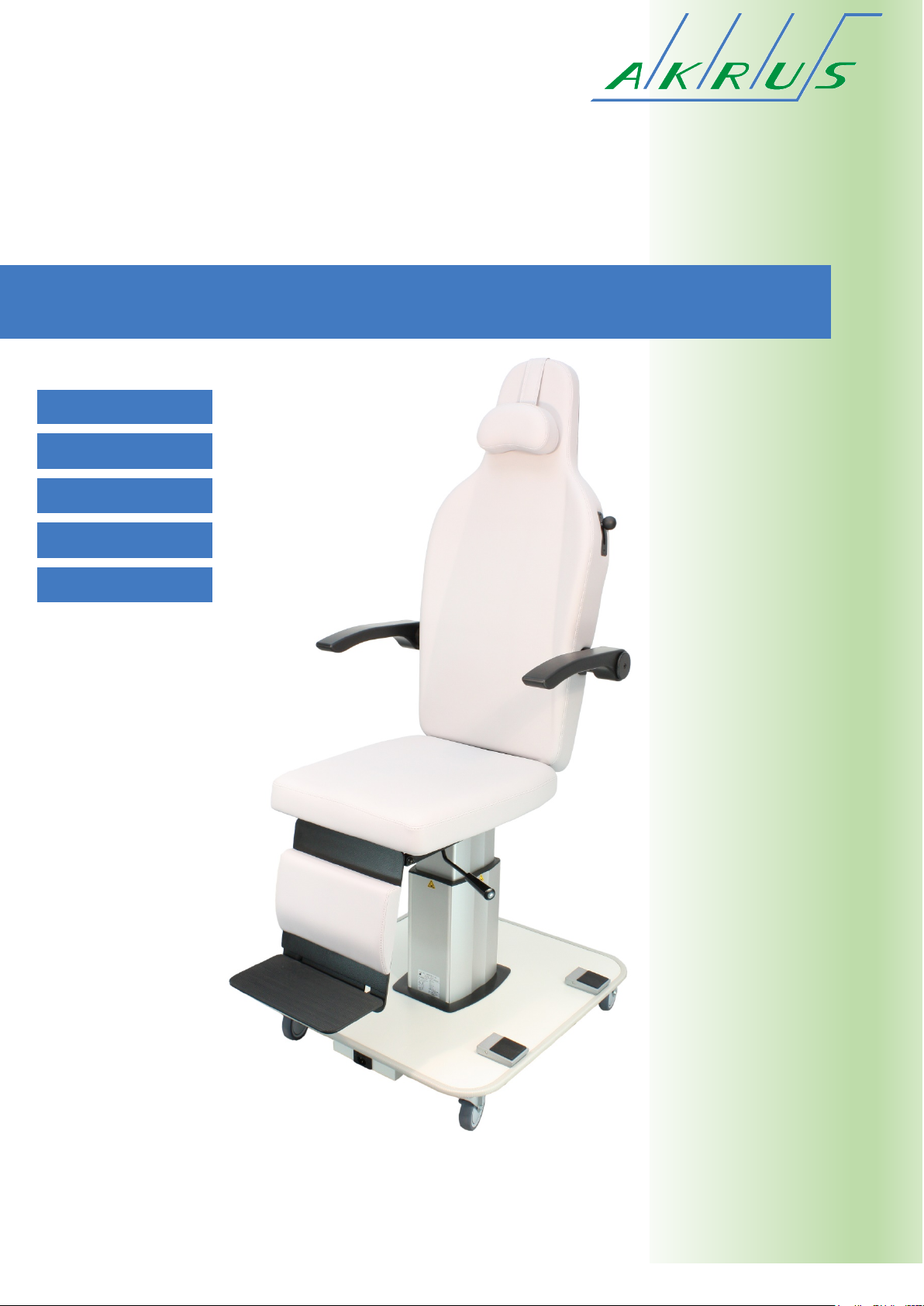
297G001D.DOCX 15.04.2019 Seite 10 von 11
10. Gerätepflege / Verschmutzungsschutz
oSchutz gegen Verschmutzung: Es wird empfohlen, das Gerät bei Gebrauch mit einer nicht
sterilen handelsüblichen flüssigkeitsresistenten Einmalfolie abzudecken, um es gegen
Verschmutzung durch Flüssigkeiten, Körperflüssigkeiten oder andere ungewollte
Substanzen zu schützen.
oDas Medizinprodukt ist mindestens resistent gegen die üblichen Desinfektionsmittel
gemäß DGHM (Deutsche Gesellschaft für Hygiene und Mikrobiologie)-Liste:
http://www.gesundheitsamt.de/alle/technik/download/seuche/bakt/list/dghm.pdf. Die
geeigneten Desinfektionsmittel dürfen eine Konzentration der Inhaltsstoffe
Propanol=35% und Ethanol=25% nicht überschreiten.
oDas Medizinprodukt ist nicht sterilisierfähig
oDie Reinigung der Lackoberflächen erfolgt mit einem feuchten (nicht nassem) Tuch, bei
hartnäckigen Verschmutzungen nicht schleifende und nicht aggressive Reinigungsmittel
verwenden. Keinen Äther, Aceton oder konzentrierte Säuren für die Reinigung der
Lackflächen benutzen.
oBei Reinigungsarbeiten ist darauf zu achten, dass kein Reinigungsmittel oder Wasser in
das Gerät eindringen kann.
oVerschmutzte Polsterflächen feucht (nicht nass) abwischen oder übliche
Polsterreinigungsmittel benutzen.
oVor der Wiederinbetriebnahme das Gerät trocknen lassen!
11. Gerätewartung
Das Medizinprodukt ist für den Anwender wartungsfrei.
Das Produkt unterliegt den Anforderungen für reguläre Wartungsintervalle. Beachten Sie hierzu
die jeweils gültige Ausgabe „Wartungsbericht“ des Herstellers.
12. Sicherheitstechnische Kontrollen
Für dieses Produkt sind keine sicherheitstechnischen Kontrollen durch den Hersteller
vorgeschrieben.
Die ggf. gesetzlich vorgeschriebenen sicherheitstechnischen Kontrollen in verschiedenen Ländern
richten sich nach den landesvorgaben für Medizinprodukte der Klasse I in ihrer jeweils gültigen
Fassung.
13. Geräteentsorgung
Das auf dem Lieferschein spezifizierte Produkt darf entsprechend den zum
Zeitpunkt der Inverkehrbringung geltenden EU-Richtlinien und nationalen
Vorschriften nicht über den Hausmüll oder kommunale Entsorgungsunternehmen
entsorgt werden.
Für nähere Informationen zur Entsorgung des Produktes wenden Sie sich bitte an ihren lokalen
Händler oder den Hersteller bzw. deren Rechtsnach-folger. Beachten Sie bitte auch die aktuellen
Internetinformationen des Herstellers.
Bei Wiederverkauf des Produktes oder dessen Bestandteilen hat der Verkäufer den Käufer davon
in Kenntnis zu setzen, dass das Produkt entsprechend den aktuell gültigen nationalen Vorschriften
entsorgt werden muss.