Somatex Tumark Q User manual

TUMARK®Q
271500
GEBRAUCHSANWEISUNG
INSTRUCTIONS FOR USE
MODE D‘UTILISATION
ΟΔΗΓΙΕΣ ΧΡΗΣΕΩΣ
ISTRUZIONI PER L’USO
INSTRUÇÕES DE UTILIZAÇÃO
MODO DE EMPLEO
ИНСТРУКЦИЯ ПО ПРИМЕНЕНИЮ
NÁVOD K POUŽITÍ
UPUTE ZA UPORABU
KASUTUSJUHEND
KÄYTTÖOHJEET
HASZNÁLATI ÚTMUTATÓ
NAUDOJIMO INSTRUKCIJOS
LIETOŠANAS INSTRUKCIJA
GEBRUIKSAANWIJZING
INSTRUKSJONER FOR BRUK
INSTRUKCJA UŻYCIA
INŠTRUKCIE NA POUŽÍVANIE
ANVÄNDNINGSINSTRUKTIONER
BRUGSANVISNING
Article No.: 999827V7-ONLINE © 2020-03 SOMATEX Medical Technologies GmbH

Tumark®Q 2/72 INHALT / CONTENT
30°C
5°C
INHALT / CONTENT
CONTENU / ΠΕΡΙΕΧΌΜΕΝΟ / SODDISFARE / CONTENTE / CONTENIDO / СОДЕРЖАНИЕ / OBSAH / SADRŽAJ /
SISU / SISÄLTÖ / TARTALOM / TURINYS / SATURU / INHOUD / INNHOLD / ZAWARTOŚĆ / OBSAH / INNEHÅLL
INDHOLD:
INHALT / CONTENT............................................................................................................................... 2
DE - DEUTSCH....................................................................................................................................... 3
EN - ENGLISH ........................................................................................................................................ 6
FR - FRANÇAIS...................................................................................................................................... 9
EL - ΕΛΛΗΝΙΚΑ .................................................................................................................................... 12
IT - ITALIANO ....................................................................................................................................... 15
PT - PORTUGUÊS................................................................................................................................ 18
ES - ESPAÑOL ..................................................................................................................................... 21
RU - РУССКИЙ ..................................................................................................................................... 24
CZ - ČESKY .......................................................................................................................................... 27
HR - HRVATSKI.................................................................................................................................... 30
ET - EESTI............................................................................................................................................. 33
FI - SUOMI............................................................................................................................................. 36
HU - MAGYAR ...................................................................................................................................... 39
LV - LATVISKI ...................................................................................................................................... 42
LT - LIETUVIŲ....................................................................................................................................... 45
NL - NEDERLANDS.............................................................................................................................. 48
NO - NORSK......................................................................................................................................... 51
PL - POLSKI ......................................................................................................................................... 54
SK - SLOVENČINA............................................................................................................................... 57
SV - SVENSKA..................................................................................................................................... 60
DA - DANSK ......................................................................................................................................... 63
SYMBOLE / SYMBOLS........................................................................................................................ 66
INFO...................................................................................................................................................... 72
Below instructions are not for use of the device in the US.
For use of the device in the USA please refer to the separate US version.

Tumark®Q 3/72 DE - DEUTSCH
30°C
5°C
DE - DEUTSC H
Vor Gebrauch sorgfältig lesen Aufbewahren bis Verpackung aufgebraucht ist
Wichtiger Hinweis:
Lesen Sie diese Gebrauchsinformation vor der Verwendung des Tumark®Q sorgfältig durch. Das Versäumnis, vor
der Verwendung des Tumark®Q diese Gebrauchsinformation vollständig zu lesen und sich mit den
Verwendungshinweisen vertraut zu machen, birgt Risiken und kann zu lebensbedrohlichen oder schweren
Verletzungen der Patienten oder Benutzer sowie zur Beschädigung oder Fehlfunktion des Produkts führen.
Zweckbestimmung und Indikation:
Der Tumark®Q dient zur perkutanen Markierung von Weichteilgewebe, wie Brustgewebe.
Zu den Anwendungsgebieten gehört das Markieren von Läsionen vor oder während einer Chemotherapie, das
Markieren einer Biopsieentnahmestelle oder am Ort eines entfernten Tumors und auch zur besseren Orientierung
für eine Bestrahlungsplanung.
Kontraindikation:
Der Tumark®Q ist ausschließlich für die oben genannten Indikationen vorgesehen.
Die Kanüle des Tumark®Q ist nicht für die Verwendung im Kernspintomographen (MRT) geeignet.
Die Anwendung des Tumark®Q ist bei Patienten mit schwerer Nickelallergie kontraindiziert.
Kurzbericht über Sicherheit und klinische Leistung gemäß Verordnung 2017/745, Art. 32 implantierbarer
Produkte auf www.somatex.de.
Warnhinweise:
Die Verwendung des Tumark®Q sollte nur durch qualifizierte Ärzte mit entsprechenden Kenntnissen,
Erfahrungen und Training in perkutaner Markierung in Weichteilgewebe erfolgen.
Diese Gebrauchsinformation enthält keine Beschreibungen oder Anleitungen für chirurgische Verfahren. Es
liegt in der Verantwortung des behandelnden Arztes, die Angemessenheit der vorgenommenen Behandlung
und der Verwendung dieses Produkts zu beurteilen und die bei den jeweiligen Patienten einzusetzende
Methode festzulegen.
Bei der Implantation des Clipmarkers nahe einem Brustimplantat ist vorsichtig vorzugehen, um eine Punktierung
der Brustimplantat-Kapsel zu vermeiden.
Der Tumark®Q ist nur vor Ablauf des Verfallsdatums und nur bei ungeöffneter, unbeschädigter Verpackung zu
verwenden! Nur wenn diese Kriterien erfüllt sind, kann die Sterilität des Produktes gewährleistet werden. Für
den Fall, dass die Verpackung beschädigt oder bereits vor der Verwendung geöffnet ist, ist das Produkt nicht
zu verwenden und der Distributor oder der Hersteller SOMATEX zu kontaktieren.
Das Produkt ist nur für den einmaligen Gebrauch vorgesehen: NICHT wiederverwenden oder resterilisieren.
Bei der Verwendung von Schleusen ist vorab die Kompatibilität mit dem Tumark®Q zu prüfen. Dabei muss das
Schliffauge der Kanülenspitze des Tumark®Q die Schleuse vollständig überragen und der Anwender muss
diesen Überstand einschätzen können, um den Clipmarker sicher applizieren zu können und diesen nicht zu
weit in das Gewebe zu setzen.
Sicherheitshinweise:
Der Clipmarker des Tumark®Q besteht aus einer Nickel-Titan-Legierung (Nitinol), weswegen das Produkt bei
Patienten mit schwerer Nickelallergie kontraindiziert ist.
Der Schieber muss während der Positionierung der Kanüle in der zurückgeschobenen Position bleiben.
Zur Platzierung des Clipmarkers muss der Schieber bis zum Anschlag vorgeschoben werden.
Es besteht Verletzungsgefahr durch scharfe Kanülenspitze: Kanüle mit besonderer Vorsicht auspacken.
Die Kanüle des Tumark®Q besteht aus NICHT MRT-kompatiblen Materialien und ist NICHT für den MR-
Sicherheitsbereich geeignet. In einer MR-Anwendung besteht Verletzungsgefahr!
Beachten Sie die Dimensionen des Clipmarkers in Bezug auf die Größe der zu markierenden Gewebeformation
(siehe Produktbeschreibung).
In seltenen Fällen kann es zum verzögerten Entfalten des Clipmarkers kommen. Die Sichtbarkeit unter
Ultraschall kann bis zum vollständigen Entfalten eingeschränkt sein
Informationen über verwendete Materialien:
Der implantierbare Clipmarker besteht aus einer Nickel-Titan-Legierung (Nitinol).
MRT Sicherheitsinformationen Applikationsgerät (Kanüle mit Griff):
MR-unsicher
Die Kanüle des Tumark®Q Applikationsgeräts ist im Gegensatz zum Clipmarker nicht für die
Verwendung im Kernspintomographen geeignet.

Tumark®Q 4/72 DE - DEUTSCH
30°C
5°C
MRT Sicherheitsinformationen Clipmarker:
bedingt
MR-sicher
Clipmarker, die bereits im Körper einer Patientin gesetzt wurden, sind bedingt MR-sicher. Eine
Patientin kann mit dem Clipmarker unter folgenden Bedingungen einem MRT-Verfahren sicher
unterzogen werden:
Statisches Magnetfeld bis 3,0 Tesla mit
theoretisch geschätzter maximaler –über den ganzen Körper gemittelter - spezifischer
Absorptionsrate (whole body averaged SAR) von 2 W/kg.
Die nicht-klinischen Tests wurden an folgenden Systemen durchgeführt:
1,5 Tesla Siemens Magnetom Avanto (Siemens Medical, Erlangen, Deutschland) MRT mit Software Numaris
4, syngo MR (Version “B13, N4_VB13A_LATEST_20060607_P29”).
3 Tesla Siemens Magnetom Skyra (Siemens Medical, Erlangen, Deutschland) MRT mit Software Numaris 4,
syngo MR (Version “D11, N4_VB11D_LATEST_20110129_P3”),
Unter den oben definierten Scan-Bedingungen wird erwartet, dass die Clipmarker von Tumark®Q folgende
maximale HF-bedingte Temperaturerhöhung erzeugen:
bei 1,5 Tesla: < 1,0 °C (2 W/kg SAR) nach 20 min kontinuierlichem Scannen;
bei 3,0 Tesla: < 1,0 °C (2 W/kg SAR) nach 20 min kontinuierlichem Scannen.
Unter den oben definierten Scan-Bedingungen wird erwartet, dass die Clipmaker von Tumark®Q maximal folgende
Bildartefakte erzeugen:
bei 1,5 Tesla: 4,3 mm Spinecho-Sequenz, 3,2 mm Gradienten-Echo-Sequenz;
bei 3,0 Tesla: 4,7 mm Spinecho-Sequenz, 4,0 mm Gradienten-Echo-Sequenz.
Clipmarker-Implantate dürfen keinen unkonventionellen, nicht standardisierten MRT-Verfahren, die nicht
in dieser Gebrauchsinformation aufgeführt sind, ausgesetzt werden, da sie hierfür NICHT GETESTET
wurden.
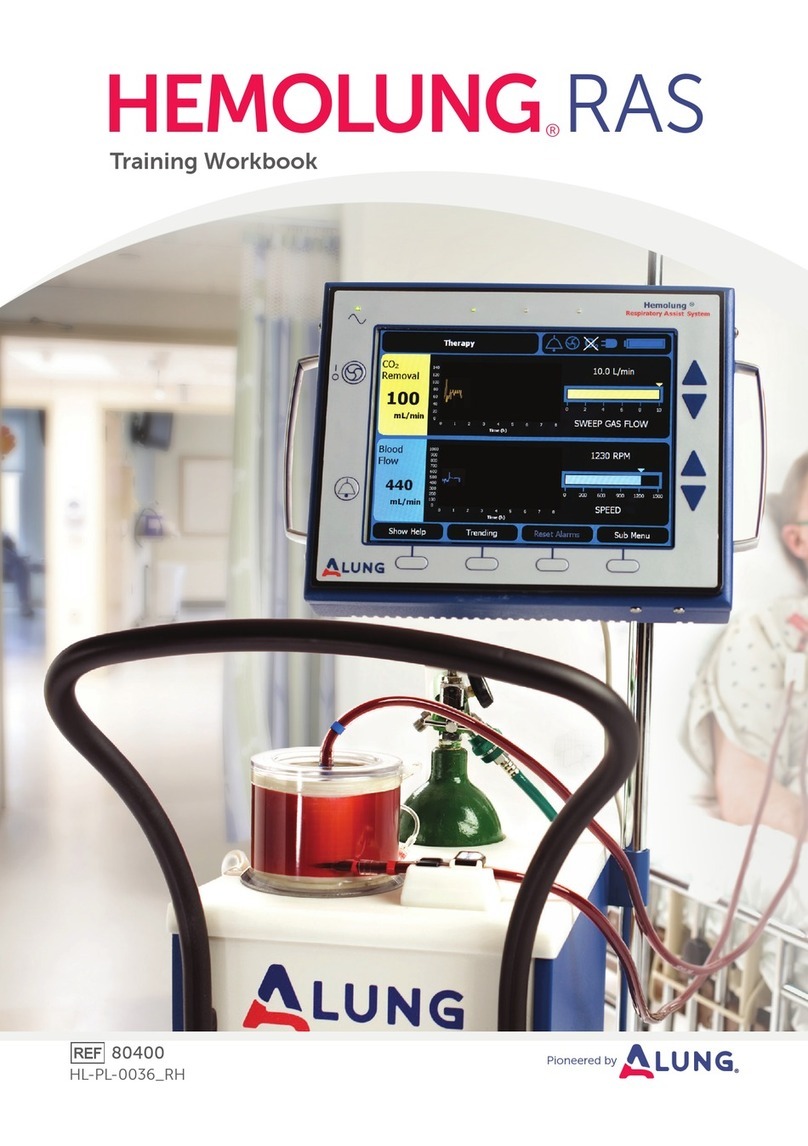
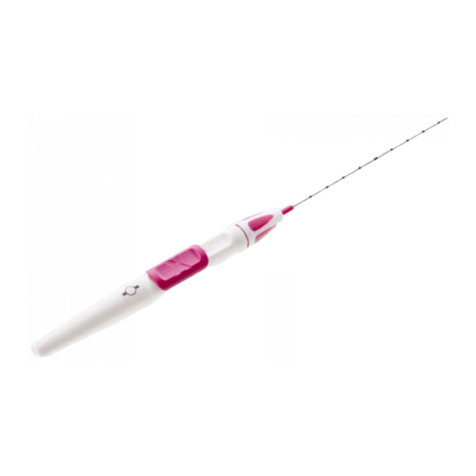
Produktbeschreibung:
Der Tumark®Q ist ein steriles Einmalprodukt und besteht aus einem nicht resorbierbaren Nickel-Titan-Clipmarker
(1), einer Kanüle (2) zur Platzierung und einem Kunststoffgriff. Im Auslieferzustand sitzt der Clipmarker in der
Kanüle. Die Kanüle verfügt über einen Schrägschliff zum Einführen, über Markierungen im Abstand von 1 cm zur
Messung der Einstichtiefe und über eine Aufrauung vor der Kanülenspitze. Die Platzierung des Clipmarkers kann
mit einer Hand durch Vorwärtsschieben des am Kunststoffgriff befindlichen Schiebers (3) erfolgen, nachdem der
Fixierungsclip (4) entfernt wurde. Eine Sicherheitsarretierung verhindert das unbeabsichtigte Vorschieben des
Schiebers und dadurch ein vorzeitiges Platzieren des Clipmarkers. Der Clipmarker hat eine Q-Form (1).
Schematische Abbildung
Dimensionen: Clipmarker
Anwendungsbeschreibung:
1. Versichern Sie sich vor dem Öffnen der Verpackung, dass diese nicht geöffnet oder beschädigt ist und dass
das Verfallsdatum in der Zukunft liegt.
2. Desinfizieren Sie die Einstichstelle und bedecken Sie ggf. die Umgebung mit sterilen Tüchern.
3. Ermitteln Sie mithilfe geeigneter bildgebender Verfahren (Ultraschall, Mammographie) den Zielbereich.
HINWEIS: Die Kanüle des Tumark®Q ist nicht für den MR-Sicherheitsbereich geeignet.
4. Öffnen Sie die Verpackung und entnehmen Sie das Produkt.
5. Entfernen Sie den Fixierungsclip (4) vom Griff und ziehen Sie den Schutzschlauch mit einer Drehbewegung
vom Ansatz der Kanüle ab.
6. Mit der Kanüle (2) den Zielbereich punktieren und die Kanüle in das Gewebe einführen. An den Markierungen
auf der Kanüle kann bei der Positionierung der Kanülenspitze die Einstichtiefe abgelesen werden.
1
2
4
3

Tumark®Q 5/72 DE - DEUTSCH
30°C
5°C
7. Position der Kanülenspitze mit geeigneten bildgebenden Verfahren überprüfen und ggf. korrigieren.
8. Clipmarker (1) platzieren, indem Sie den Schieber (3) fest bis zum Anschlag vorschieben.
9. Lage des Clipmarkers (1) überprüfen und dokumentieren.
10. Kanüle (2) entfernen.
11. Wundstelle versorgen.
12. Nach der Anwendung: fachgerechte Entsorgung des Applikationsgeräts, ggf. nach internen Vorgaben, jedoch
sollte mindestens ein geeigneter und für kontaminierte Kanülen vorgesehener Behälter verwendeten werden,
um eine sichere Entsorgung zu gewährleisten.
Warnhinweis:
Die Firma SOMATEX lehnt im Falle einer Resterilisation oder Wiederverwendung jede Verantwortung für die
Nutzung dieses Produktes oder einzelner Produktbestandteile ab. Dieses Produkt darf nach einmaliger Anwendung
nicht wiederverwendet werden. Die Qualität der Materialien, Beschichtungen und Klebeverbindungen können sich
verschlechtern. Eine sichere Anwendung ist nicht mehr gewährleistet. Das Produkt ist nach einmaliger Verwendung
nicht für die notwendigen Reinigungs- und Sterilisierungsprozesse ausgelegt. Die Sterilität der wiederaufbereiteten
Einmalprodukte ist somit nicht gewährleistet. Das Risiko von ungewollten Verletzungen und Infektionen,
insbesondere Kreuzinfektionen bei Patient und medizinischem Personal steigt unangemessen.
Lagerungshinweise:
Trocken aufbewahren.
Vor Sonne und Hitze schützen (Temperatur zwischen 5 –30 °C).
Alle im Zusammenhang mit dem Produkt aufgetretenen schwerwiegenden Vorfälle sind der SOMATEX Medical
Technologies GmbH und der zuständigen nationalen Behörde zu melden.

Tumark®Q 6/72 EN - ENGLISH
30°C
5°C
EN - ENG LISH
Read instructions before use Keep for future reference
Important Information:
Read this instruction manual thoroughly and be familiar with its contents prior to use of the Tumark®Q. Failure to
read the entire manual and familiarize yourself with all instructions before using the Tumark®Q is unsafe and can
result in life-threatening or severe injury to the patient or user and to damage or malfunction of the device.
Intended use and indications for use:
The Tumark®Q is intended for the percutaneous marking of soft tissue, such as breast tissue.
Among its areas of application are marking of lesions prior to or during chemotherapy, marking the site of a biopsy
or of a removed tumor, or prior to radiotherapy for better treatment planning.
Contraindications:
The Tumark®Q is not intended for use except as indicated above.
The Tumark®Q cannula is not suitable for use with magnetic resonance imaging (MRI).
The Tumark®Q is contraindicated in patients with severe nickel allergy.
A summary of safety and clinical performance in accordance with Article 32 of Regulation 2017/745
(implantable devices) is available at www.somatex.de.
Warnings:
Only qualified physicians with knowledge, experience and training in percutaneous soft tissue marking shall use
the Tumark®Q.
This manual does not include descriptions or instructions for surgical techniques. It is the responsibility of the
physician performing any procedure to determine the appropriateness of the procedure to be performed and of
the use of this device and to determine the specific technique for each patient.
When implanting a clip marker near a breast implant, handle with care to avoid puncturing the breast implant.
The Tumark®Q should only be used before the expiry date and only if the packaging is unopened and
undamaged. Product sterility can only be guaranteed if these criteria are met. If the expiry date is exceeded or
if the packaging is damaged or opened before use, the product should not be used and the distributor or
manufacturer, SOMATEX, should be contacted.
The product is intended for single use only: DO NOT reuse or resterilize.
When using a positioning needle, the Tumark®Q must be checked for compatibility in advance. The bevelled
Tumark®Q cannula tip opening should protrude fully out of the positioning needle, and the user should be able
to gauge this protrusion in order to be able to apply the clip marker safely and not place it too far into the tissue.
Precautions:
The Tumark®Q clip marker is made from a nickel-titanium alloy (Nitinol), which is why the product is
contraindicated in patients with severe nickel allergy.
Make sure that the slide button remains in the retracted position while the cannula is being put in position.
The clip marker must be placed by pushing the slide button forward as far as possible to the stop position.
There is risk of injury due to the sharp cannula tip. Use care especially when unpacking the cannula.
The cannula of Tumark®Q is NOT made of MRI-compatible metals. NOT suitable for MRI safety area. Danger
of injury!
Pay attention to the dimensions of the clip marker in relation to the size of the tissue area being marked (see
Product Description).
In rare cases the expansion of the clip marker may be delayed. Visibility in radiological imaging might be
compromised until full expansion.
Information about materials used:
The implantable clip marker is made from a nickel-titanium alloy (Nitinol).
MRI Safety Information application system (cannula with handle):
MR unsafe
Unlike the clip marker, the Tumark®Q cannula application device is not suitable for use in an MRI
scanner.
MRI Safety Information clip marker:
MR
conditional
The clip marker is conditionally MR safe. A patient can safely undergo an MRI procedure with the
clip marker under the following conditions:
static magnetic field up to 3.0 Tesla with
theoretically estimated maximum whole body averaged (WBA) specific absorption rate (SAR)
of 2 W/kg.
Tumark®Q 7/72 EN - ENGLISH
30°C
5°C
Non-clinical tests were performed on the following systems:
1.5 Tesla Siemens Magnetom Avanto (Siemens Medical, Erlangen, Germany) MRI with software Numaris 4,
syngo MR (Version “B13, N4_VB13A_LATEST_20060607_P29”).
3 Tesla Siemens Magnetom Skyra (Siemens Medical, Erlangen, Germany) MRI with software Numaris 4,
syngo MR (Version “D11, N4_VB11D_LATEST_20110129_P3”);
Under the scanning conditions defined above, it is expected that clip marker of Tumark®Q will produce the following
maximum RF-related temperature rise:
at 1.5 Tesla: < 1,0 °C (2 W/kg SAR) after 20 min of continous scanning,
at 3.0 Tesla: < 1,0 °C (2 W/kg SAR) after 20 min of continous scanning.
Under the scanning conditions defined above, it is expected that clip marker of Tumark®Q will produce the following
image artefacts:
at 1.5 Tesla: 4.3 mm spin echo sequence; 3.2 mm gradient echo sequence;
at 3.0 Tesla: 4.7 mm spin echo sequence; 4.0 mm gradient echo sequence.
Do not expose the implanted clip marker to unconventional and non-standardized MRI techniques other
than the ones listed above, because it has NOT BEEN TESTED for that purpose.
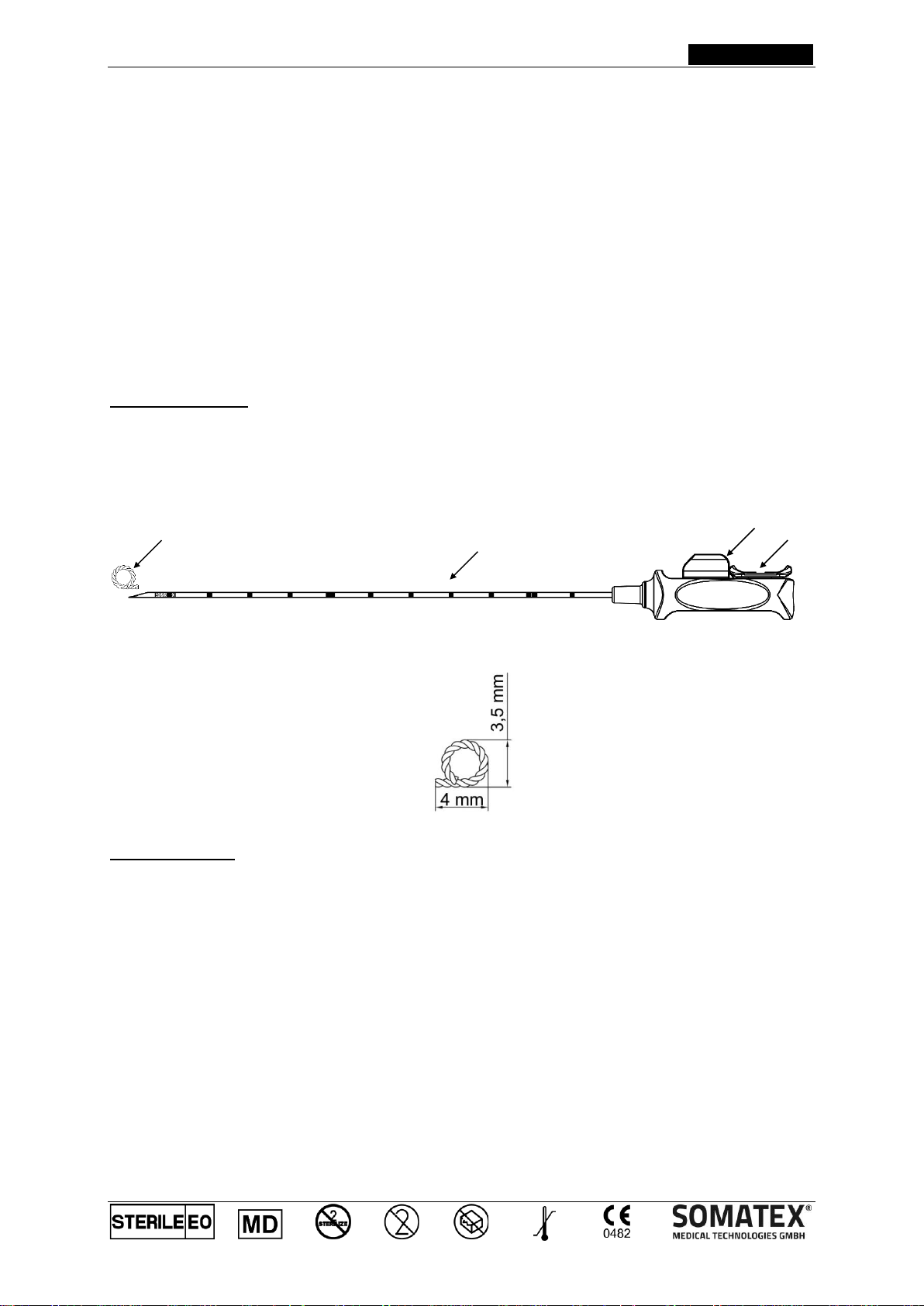
Product Description:
This is a sterile product for single use only and consists of a non-absorbable nickel-titanium clip marker (1), an
introducer cannula (2) and a plastic handle. When new and unopened, the clip marker is contained within the
cannula. The cannula tip is bevelled to help insertion, has markings 1 cm apart for measuring the depth of
penetration, and a textured surface behind the cannula tip. The clip marker can be placed using one hand by
pushing the slide button on the plastic handle forward (3) once the fixing clip (4) has been removed. A safety catch
system prevents the slide button from inadvertently moving forward and therefore prevents premature deployment
of the clip marker. The clip marker has a Q-shape (1).
schematic illustration
dimensions of clip marker
Directions for Use:
1. Before opening, make sure that the packaging is not already open or damaged and that it is within the expiry
date.
2. Disinfect the puncture area and cover the area around it with sterile drapes if required.
3. Use suitable imaging methods (ultrasound, mammography) to identify the target area. NOTE: the Tumark®Q
cannula is not suitable for the MRI safety zone.
4. Open the packaging and remove the product from packaging.
5. Remove the fixing clip (4) from the handle and remove the outer cannula by twisting it from the base.
6. Use the cannula (2) to puncture the target area, and insert into the tissue. The depth of insertion can be read
from the markings on the cannula when positioning the cannula tip.
7. Check the position of the cannula tip using suitable imaging techniques, and adjust if appropriate.
8. Place the clip marker (1) by pushing the slide button (3) forward as far as it will go.
9. Verify and record the position of the clip marker (1).
10. Remove the cannula (2).
11. Treat the wound.
12. After use: dispose the application device properly, following internal guidelines if appropriate; however, at least
one suitable container intended for contaminated cannulas should be provided to ensure safe disposal.
2
3
1
4

Tumark®Q 8/72 EN - ENGLISH
30°C
5°C
Warning:
The company SOMATEX does not assume any liability for the use of this product or its components in case of re-
sterilisation or reuse. This product may not be reused after a single application. The quality of the materials, coats
and adhesive joints could degrade. Safe use is not guaranteed any longer. The product that is already used once
is not designed for the required cleaning and sterilization processes. The sterility of the reprocessed disposable
products is therefore not guaranteed. The risk of unwanted injuries and infections, especially cross-infections
between patient and medical staff inappropriately increases.
Storage Instructions:
Keep away from sunlight and heat.
Store in a dry area at a temperature of 5 –30 °C.
Any serious events that occur in relation to the product should be reported to SOMATEX Medical Technologies
GmbH, as well as the competent national authority.

Tumark®Q 9/72 FR - FRANÇAIS
30°C
5°C
F R - F RAN Ç AI S
Consultez la notice avant utilisation À conserver à des fins de référence ultérieure
Informations importantes :
Lisez attentivement cette notice en entier et familiarisez-vous avec son contenu avant d'utiliser l'appareil. Le fait de
ne pas lire intégralement cette notice et de ne pas vous familiariser avec l'ensemble des instructions avant d'utiliser
le Tumark®Q est dangereux et peut entraîner un risque de blessure grave ou mortelle pour le patient ou l'utilisateur
ainsi qu'une dégradation ou un dysfonctionnement du dispositif.
Utilisation prévue et Indication :
Le Tumark®Q est destiné au marquage des tissus mous, tels que les tissus mammaires.
Parmi ses domaines d'application figurent le marquage des lésions avant ou pendant la chimiothérapie, le
marquage du site d'une biopsie ou d'une tumeur ayant été enlevée, ou encore avant la radiothérapie pour une
meilleure planification du traitement.
Contre-indications :
Le Tumark®Q n'est pas destiné à un autre usage que celui indiqué ci-dessus.
La canule Tumark®Q n’est pas adaptée à une utilisation avec Imagerie par résonance magnétique (IRM).
Tumark®Qest contre-indiqué chez les patients présentant une allergie au nickel sévère.
Un résumé sur la sécurité et les performances cliniques conformément à l'article 32 du règlement 2017/745
(dispositifs implantables) est disponible sur www.somatex.de.
Avertissements :
Seuls les médecins qualifiés ayant les connaissances, l'expérience et la formation requises pour le marquage
percutané de tissus mous peuvent utiliser le Tumark®Q.
Ce mode d'emploi ne comprend pas de descriptions ou d'instructions concernant les techniques chirurgicales.
La responsabilité de définir la pertinence du type de procédure à pratiquer, de l'utilisation de ce produit et de la
technique spécifique pour chaque patient incombe au médecin effectuant tout type de procédure.
Lors de l'implantation d'un clip repère à proximité d'un implant mammaire, agir avec précaution afin d'éviter de
perforer l'implant mammaire.
Avant l'ouverture, vérifiez bien que l'emballage n'est pas déjà ouvert ou endommagé, que la date de péremption
n’est pas dépassée. La stérilité du produit ne peut être garantie que si ces critères sont remplis. Si l'emballage
est endommagé ou ouvert avant utilisation, le produit ne doit pas être utilisé et le distributeur ou le fabricant,
SOMATEX, doit être contacté.
Le produit est destiné à un usage unique : veuillez NE PAS le réutiliser ni le restériliser.
Lors de l'utilisation d'une aiguille de positionnement, la compatibilité de Tumark®Q doit être vérifiée à l'avance.
L'extrémité biseautée de la canule Tumark®Q doit dépasser complètement de l'aiguille de positionnement, et
l'utilisateur doit être capable de mesurer cette protubérance afin de pouvoir appliquer le clip repère en toute
sécurité et ne pas le placer trop loin dans le tissu.
Précautions :
Le clip repère Tumark®Q est fabriqué à partir d'un alliage nickel-titane (Nitinol), c'est pourquoi le produit est
contre-indiqué chez les patients présentant une allergie sévère au nickel.
Assurez-vous que le bouton coulissant reste en position rentrée lors de la mise en place de la canule.
Le clip repère doit être positionné en poussant le bouton coulissant le plus loin possible en avant jusqu'en
position Arrêt.
Il existe un risque de blessure en raison de la pointe tranchante de la canule. À manipuler avec précaution, en
particulier lors du déballage de la canule.
La canule du Tumark®Q n'est PAS composée de métaux compatibles IRM. NON adapté à la zone de sécurité
IRM. Risque de blessures!
Respectez les dimensions du clip repère par rapport à la taille de la zone de tissu marquée (voir Description du
produit).
Dans de rares cas, l'expansion du clip repère peut être retardée. La visibilité dans l'imagerie radiologique
pourrait être compromise jusqu'à expansion totale.
Informations sur les matériaux utilisés :
Le clip repère implantable est fabriqué à partir d’un alliage nickel-titane (Nitinol)
Système d’application informations de sécurité pour l’IRM (canule avec poignée) :
Incompatible
avec la RM
Contrairement au clip repère, le dispositif d'application de la canule Tumark®Q ne convient pas pour
une utilisation dans un scanner IRM.

Tumark®Q 10/72 FR - FRANÇAIS
30°C
5°C
Clip de repérage informations de sécurité pour IRM :
soumis à la
réglementation
RM
Le clip repère est soumis à la réglementation RM. Une IRM peut être réalisée sur un patient en
toute sécurité par le marqueur dans les conditions suivantes :
champ magnétique statique allant jusqu'à 3,0 T avec
un débit d'absorption spécifique (DAS) moyen sur le corps entier (WBA) maximal
théoriquement estimé à 2 W/kg.
Des tests non cliniques ont été réalisés sur les systèmes suivants :
l’IRM Magnetom Avanto de Siemens (Siemens Medical, Erlangen, Allemagne) de 1,5 T avec le logiciel Numaris
4, syngo MR (Version « B13, N4_VB13A_LATEST_20060607_P29 »).
l’IRM Magnetom Skyra de Siemens (Siemens Medical, Erlangen, Allemagne) de 3 T avec le logiciel Numaris
4, syngo MR (Version « D11, N4_VB11D_LATEST_20110129_P3 »);
Dans les conditions de balayage définies ci-dessus, le clip de repérage du Tumark®Q devrait produire
l’augmentation de température maximale suivante liée aux RF :
à 1,5 T : < 1,0 °C (2 W/kg DAS) après 20 min de balayage continu,
à 3,0 T : < 1,0 °C (2 W/kg DAS) après 20 min de balayage continu.
Dans les conditions d’imagerie définies ci-dessus, le clip de repérage du Tumark®Q devrait produire les artefacts
d'image suivants :
à 1,5 T : séquence en écho de spin de 4,3 mm ; séquence en écho de gradient de 3,2 mm;
à 3,0 T : séquence en écho de spin de 4,7 mm ; séquence en écho de gradient de 4,0 mm.
Ne pas exposer le clip repère implanté à des techniques d'IRM non traditionnelles et non standardisées
autres que celles énumérées dans la liste ci-dessus, étant donné qu'il n'a PAS ÉTÉ TESTÉ pour cette
utilisation.
Description du produit :
Le Tumark®Q est un système de marquage de tissu préchargé, stérile, à usage unique composé d’un clip repère
en nickel-titane non absorbable (1), d’une canule d’insertion (2) et d’une poignée en plastique. Lorsqu'il est neuf et
non ouvert, le clip repère est contenu dans la canule. La pointe de la canule est biseautée pour faciliter l'insertion
et présente des marques à des intervalles de 1 cm pour mesurer la profondeur de pénétration, ainsi qu'une surface
texturée derrière la pointe de la canule. Le clip repère peut être placé d'une main en poussant le coulisseau (3) de
la poignée en plastique vers l'avant une fois le clip de fixation (4) retiré. Un système de verrouillage de sécurité
évite que le bouton coulissant n'avance par inadvertance et prévient ainsi le déploiement prématuré du marqueur.
Le clip repère est de forme Q (1).
représentation schématique
dimensions du clip repère
Mode d'emploi:
1. Avant d'ouvrir l'emballage, assurez-vous qu'il n'a pas été ouvert ou endommagé. Par ailleurs, vérifiez la date
de péremption de la stérilisation.
2. Désinfectez le point d'injection et, le cas échéant, couvrez la zone avec des lingettes stériles.
3. Utilisez les méthodes d'imagerie appropriées (échographie, mammographie) pour identifier la zone cible.
REMARQUE : la canule du Tumark®Q n'est pas adaptée à la zone de sécurité IRM.
4. Ouvrez le produit et retirez-le de son emballage.
5. Retirez le clip de fixation (4) de la poignée et retirez la gaine de protection de la base de la canule avec un
mouvement de rotation.
6. Utilisez la canule (2) pour perforer la zone cible et insérez-la dans le tissu. La profondeur d'insertion peut être
lue à partir des marquages sur la canule lors du positionnement de la pointe de la canule.
7. Vérifiez la position de la pointe de la canule à l'aide des techniques d'imagerie appropriées et ajustez-la si
nécessaire.
2
3
1
4

Tumark®Q 11/72 FR - FRANÇAIS
30°C
5°C
8. Placez le clip repère (1) en poussant le piston (3) aussi loin vers l'avant que possible.
9. Vérifiez et enregistrez la position du clip repère (1).
10. Retirez la canule (2).
11. Traitez le site de la plaie.
12. Après utilisation : jetez le dispositif d'application correctement, en suivant les directives internes le cas
échéant ; cependant, au moins un récipient approprié destiné aux canules contaminées doit être utilisé pour
assurer une élimination sûre.
Avertissement :
L'entreprise SOMATEX décline toute responsabilité concernant l'utilisation de ce produit ou de ses composants à
la suite d'une restérilisation ou d'une réutilisation. Ce produit ne peut pas être réutilisé après une seule application.
La qualité des matériaux, des revêtements et des joints adhésifs pourrait se dégrader. L'utilisation en toute sécurité
n'est plus garantie. Le produit qui a déjà été utilisé une fois n'est pas conçu pour les processus obligatoires de
nettoyage et de stérilisation. La stérilité des produits jetables retraités n'est par conséquent pas garantie. Le risque
de blessures et d'infections indésirables, notamment de contaminations croisées entre patient et personnel médical,
augmente de manière inappropriée.
Instructions de stockage :
Maintenir au sec.
Maintenir à l'abri de la lumière du soleil et de la chaleur (température entre 5 –30 °C).
Tout événement grave survenant suite à l’utilisation du produit doit être signalé à SOMATEX Medical Technologies
GmbH, ainsi qu'à l'autorité nationale compétente.

Tumark®Q 12/72 EL - ΕΛΛΗΝΙΚΑ
30°C
5°C
EL - Ε Λ Λ Η Ν Ι Κ Α
Διαβάστε τις οδηγίες πριν από τη χρήση Φυλάξτε τις για μελλοντική αναφορά
Σημαντικές πληροφορίες:
Πριν από τη χρήση, διαβάστε διεξοδικά το παρόν εγχειρίδιο οδηγιών και εξοικειωθείτε με το περιεχόμενό του. Η
παράλειψη της ανάγνωσης ολόκληρου του εγχειριδίου και της εξοικείωσης με το σύνολο των οδηγιών πριν από τη
χρήση του συστήματος Tumark®Q αποτελεί επισφαλή πρακτική και μπορεί να οδηγήσει σε απειλητικό για τη ζωή
ή σοβαρό τραυματισμό του ασθενούς ή του χρήστη και σε ζημιά ή δυσλειτουργία της διάταξης.
Προοριζόμενη χρήση και Ενδείξεις:
Η Tumark®Q προορίζεται για την επισήμανση του μαλακού μορίου, όπως ιστών μαστού.
Ανάμεσα στους τομείς εφαρμογής της είναι η επισήμανση αλλοιώσεων πριν από ή κατά τη διάρκεια
χημειοθεραπείας. Επισήμανση του σημείου μιας βιοψίας ή ένος όγκου που αφαιρέθηκε, ή πριν από την
ακτινοθεραπέια για καλύτερο προγραμματισμό θεραπείας.
Αντενδείξεις:
Το σύστημα Tumark®Q δεν προορίζεται για χρήση πέραν της προαναφερόμενης.
ΗTumark®Q κάνουλα δεν είναι κατάλληλη για χρήση με την απεικόνιση μαγνητικού συντονισμού (MRI).
Το Tumark®Q αντενδείκνυται σε ασθενείς με σοβαρού βαθμού αλλεργία στο νικέλιο.
Μια περίληψη των αποδέσεων ασφαλείας και των κλινικών αποδόσεων σε συμφωνία με το άρθρο 32 του
Κανονισμού 2017/45 (εμφυτεύσιμες συσκευές) είναι διαθέσιμη στο www.somatex.de.
Προειδοποιήσεις:
Το σύστημα Tumark®Q πρέπει να χρησιμοποιείται αποκλειστικά από εξειδικευμένους ιατρούς με γνώση,
εμπειρία και εκπαίδευση στη διαδερμική σήμανση μαλακών ιστών.
Το παρόν εγχειρίδιο δεν περιλαμβάνει περιγραφές ή οδηγίες σχετικά με χειρουργικές τεχνικές. Αποτελεί ευθύνη
του ιατρού που πραγματοποιεί την επέμβαση να καθορίσει την καταλληλότητα της επέμβασης που θα
πραγματοποιηθεί και της χρήσης της παρούσας διάταξης, ενώ οφείλει να καθορίσει και τη συγκεκριμένη τεχνική
για κάθε ασθενή.
Κατά την εμφύτευση ενός κλιπ δείκτη κοντά σε ένα εμφύτευμα μαστού, είναι επιβεβλημένος ο προσεκτικός
χειρισμός του προκειμένου να αποφύγετε διάτρηση του εμφυτεύματος μαστού.
Πριν από το άνοιγμα, βεβαιωθείτε ότι η συσκευασία δεν είναι ήδη ανοιχτή ή δεν έχει υποστεί ζημιές, ότι δεν έχει
περάσει η ημερομηνία λήξεως του προϊόντος. Η αποστείρωση του προϊόντος είναι εγγυημένη μόνο όταν
τηρούνται αυτές οι προϋποθέσεις. Αν η συσκευασία έχει υποστεί ζημιές ή είναι ανοιχτή πριν από τη χρήση, το
προϊόν δεν θα πρέπει να χρησιμοποιείται και θα πρέπει να επικοινωνήσετε με το διανομέα ή τον κατασκευαστή
SOMATEΧ.
Το προϊόν προορίζεται για μία μόνο χρήση: ΝΑ ΜΗΝ επαναχρησιμοποιείται ούτε να επαναποστειρώνεται.
Όταν κάνετε χρήση μιας βελόνας προσανατολισμού, πρέπει εκ των προτέρων να ελέγξετε για συμβατότητα με
τον Tumark®Q. Η άκρη του ματιού της εξομαλυμένης κάνουλας Tumark®Q θα πρέπει να προεξέχει πλήρως
έξω από την βελόνα προσανατολισμού και ο χρήστης θα πρέπει να μπορεί να μετρήσει την παραπάνω
προέκταση προκειμένου να μπορεί να εφαρμόσει τον δείκτη πόρπης με ασφάλεια και να μην τον τοποθετήσει
σε υπερβολικά μεγάλο εύρος με κατεύθυνση μέσα στον ιστό.
Προφυλάξεις:
Ο Tumark®Q ενδείκτης πόρπης είναι κατασκευασμένος από ένα κράμα νικελίου και τιτάνιου (Νιτινόλη) και για
αυτόν το λόγο το προϊόν αντενδείκνυται για ασθενείς με σοβαρής μορφής αλλεργία στο νικέλιο.
Φροντίζετε ώστε το κουμπί ολίσθησης να παραμένει στη θέση ανάσυρσης κατά την τοποθέτηση της βελόνης.
Οκλιπ δείκτης πρέπει να τοποθετείται πιέζοντας το κουμπί ολίσθησης προς τα εμπρός όσο το δυνατόν
περισσότερο στη θέση αναστολής.
Υπάρχει κίνδυνος τραυματισμού εξαιιτίας της αιχμηρής άκρης της κάνουλας. Επιδεικνύετε προσοχή, ειδικά κατά
την αποσυσκευασία της βελόνης.
Η βελόνη του συστήματος Tumark®Q ΔΕΝ κατασκευάζεται από συμβατά με τη μαγνητική τομογραφία μέταλλα.
ΔΕΝ ενδείκνυται για ασφαλή περιοχή μαγνητικής τομογραφίας. Κίνδυνος τραυματισμού!
Να προσέχετε τις διαστάσεις του ενδείκτη πόρπης σε σχέση με το μέγεθος της περιοχής του ιστού που
σημαίνεται (βλέπε Περιγραφή Προϊόντος).
Σε σπάνιες περιπτώσεις, η ανάπτυξη του κλιπ δείκτη ενδέχεται να καθυστερήσει. Η ορατότητα στην
ακτινοσκοπική απεικόνιση ενδέχεται να υποβαθμιστεί έως την πλήρη ανάπτυξη.
Πληροφορίες για τα υλικά που χρησιμοποιούνται:
Ο εμφυτεύσιμος ενδείκτης πόρπης είναι κατασκευασμένος από ένα μείγμα νικελίου και τιτάνιου (Νιτινόλης).
Tumark®Q 13/72 EL - ΕΛΛΗΝΙΚΑ
30°C
5°C
Πληροφορίες ασφάλειας για το σύστημα εφαρμογής σε περιβάλλον μαγνητικής τομογραφίας
(Κάνουλα με λαβή):
Μη ασφαλές για
μαγνητική
τομογραφία
Το σύστημα Tumark®Q ως σύστημα εφαρμογής για κλιπ-δείκτη δεν ενδείκνυται για χρήση σε
περιβάλλον μαγνητικής τομογραφίας.
Πληροφορίες ασφάλειας για το κλιπ-δείκτη σε περιβάλλον μαγνητικής τομογραφίας:
MR conditional
(MR υπο όρους)
Το κλιπ-δείκτη είναι ασφαλές με MR υπό όρους. Ένας ασθενής μπορεί να υποβληθεί με
ασφάλεια σε διαδικασία MRI με το κλιπ-δείκτη υπό τις ακόλουθες συνθήκες:
στατικό μαγνητικό πεδίο έως και 3,0 T με
θεωρητικά εκτιμώμενο μέγιστο ρυθμό ειδικής απορρόφησης (SAR) μεσοτιμημένο για
ολόκληρο το σώμα (WBA) 2 W/kg.
Μη κλινικές δοκιμές πραγματοποιήθηκαν στα ακόλουθα συστήματα:
1,5 T Siemens Magnetom Avanto (Siemens Medical, Erlangen, Γερμανία) MRI με λογισμικό Numaris 4, syngo
MR (Έκδοση «B13, N4_VB13A_LATEST_20060607_P29»).
3 T Siemens Magnetom Skyra (Siemens Medical, Erlangen, Γερμανία) MRI με λογισμικό Numaris 4, syngo
MR (Έκδοση «D11, N4_VB11D_LATEST_20110129_P3»);
Υπό τις συνθήκες σάρωσης που ορίζονται παραπάνω, αναμένεται ότι το κλιπ-δείκτης του Tumark®Q θα παράγει
την ακόλουθη μέγιστη, σχετιζόμενη με ενέργεια ραδιοσυχνοτήτων (RF), θερμοκρασιακή αύξηση:
στο 1,5 T: < 1,0 °C (2 W/kg SAR) έπειτα από 20 λεπτά συνεχούς σάρωσης,
στα 3,0 T: < 1,0 °C (2 W/kg SAR) έπειτα από 20 λεπτά συνεχούς σάρωσης.
Υπό τις συνθήκες σάρωσης που ορίζονται παραπάνω, αναμένεται ότι το κλιπ-δείκτης του Tumark®Q θα παράγει
τα ακόλουθα παράσιτα εικόνας:
στο 1,5 T: 4,3 mm ακολουθία ηχούς ιδιοστροφορμής (spin echo); 3,2 mm ακολουθία βαθμιδωτής ηχούς
(gradient echo),
στα 3,0 T: 4,7 mm ακολουθία spin echo; 4,0 mm ακολουθία gradient echo.
Μην εκθέτετε το εμφυτευμένο κλιπ-δείκτη σε μη συμβατικές ή μη τυποποιημένες τεχνικές MRI πέραν των
προαναφερόμενων, διότι το σύστημα ΔΕΝ ΕΧΕΙ ΕΛΕΓΧΘΕΙ για τον σκοπό αυτό.
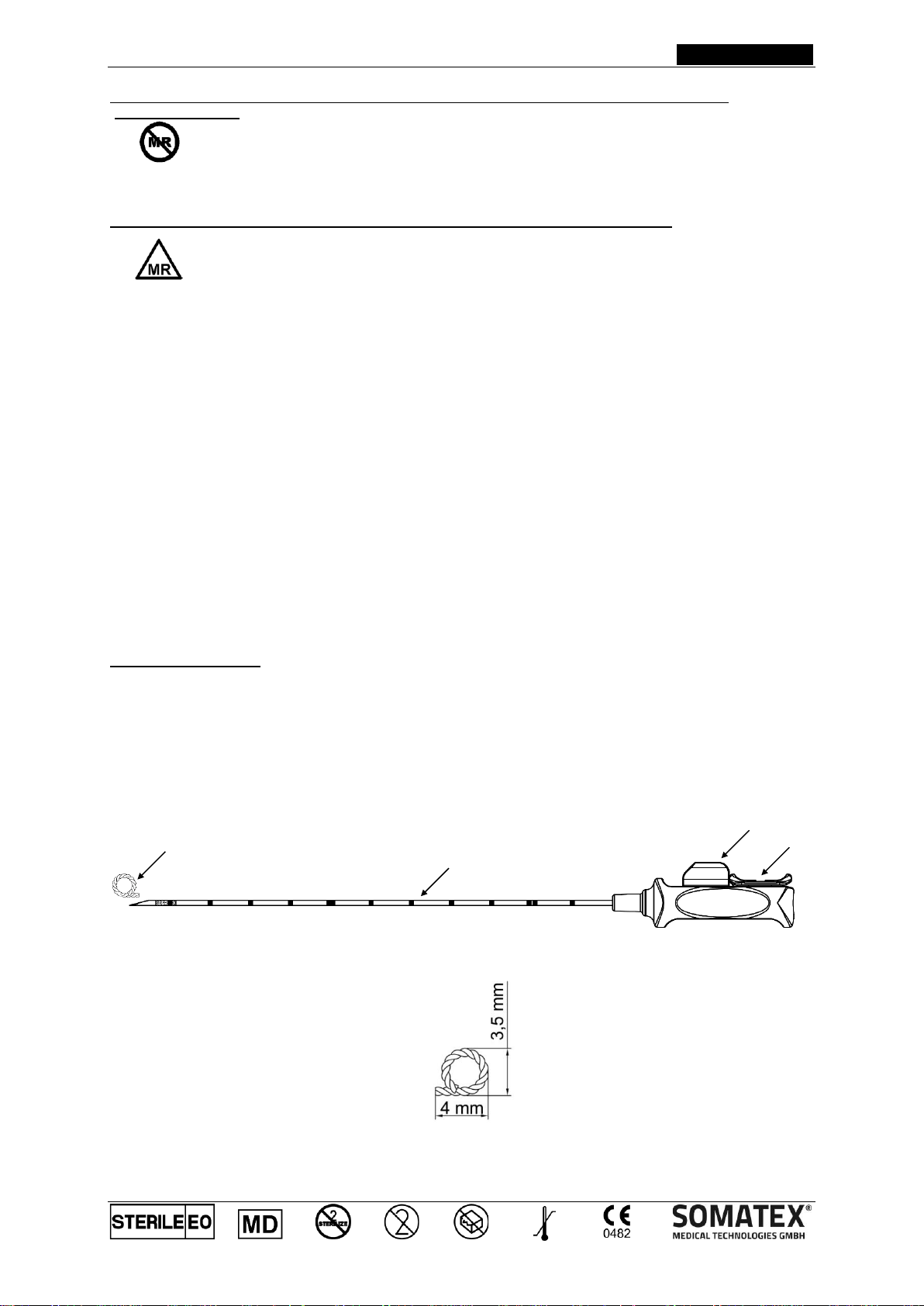
Περιγραφή Προϊόντος:
Το Tumark®Q είναι ένα στείρο, μίας χρήσης, προφορτωμένο σύστημα σήμανσης θέσεων ιστού αποτελούμενο από
έναν μη απορροφήσιμο δείκτη από νικέλιο-τιτάνιο (1), μια βελόνη εισαγωγής (2) και μια πλαστική λαβή. Όταν είναι
καινούριο και σφραγισμένο, ο ενδείκτης πόρπης περιέχεται εντός της κάνουλας. Η άκρη της κάνουλας είναι
εξομαλυμένη για τη συμβολή στην εισχώρηση και έχει ενδείξεις κάθε 1 εκατοστό για τη μέτρηση του βάθους της
διάρτησης και μια ανάγλυφη επιφάνεια πίσω από την άκρη της κάνουλας. Η πόρπη σήμανσης μπορεί να
τοποθετηθεί με τη χρήση ενός χεριού με την ώθηση της γλυστρίδας στην πλαστική λαβή προς τα εμπρός (3) μόλις
η πόρπη σταθεροποιήσης (4) έχει αφαιρεθεί. Ένα σύστημα συγκράτησης ασφαλείας αποτρέπει την κατά λάθος
μετακίνηση του κουμπιού ολίσθησης προς τα εμπρός αποτρέποντας έτσι και την πρόωρη έκπτυξη του δείκτη. Το
κλιπ-δείκτη έχει Q σχήμα (1).
Σχηματική αναπαράσταση
διαστάσεις κλιπ-δείκτη
2
3
1
4

Tumark®Q 14/72 EL - ΕΛΛΗΝΙΚΑ
30°C
5°C
Οδηγίες χρήσης:
1. Πριν από το άνοιγμα, βεβαιωθείτε ότι η συσκευασία δεν είναι ήδη ανοιχτή ή δεν έχει υποστεί ζημιές, ότι δεν
έχει περάσει η ημερομηνία λήξεως του προϊόντος.
2. Απολυμάνετε το σημείο ένεσης και, αν είναι κατάλληλη μια τέτοια ενέργεια, καλύψτε την περιοχή με
αποστειρωμένα υγρομάντηλα.
3. Να χρησιμοποιείτε κατάλληλες μεθόδους απεικόνισης (υπέρηχος, μαστογραφία) για να αναγνωρίσετε την
περιοχή στόχο. ΣΗΜΕΙΩΣΗ: Η κάνουλα Tumark®Q δεν είναι κατάλληλη για την ασφαλή ζώνη MRI.
4. Ανοίξτε το προϊόν και αφαιρέστε τη συσκευασία.
5. Αφαιρέστε την πόρπη σταθεροποίησης (4) από την λαβή και αφαιρέστε την εξωτερική κάνουλα
περιστρέφοντάς την από την βάση.
6. Χρησιμοποιείστε την κάνουλα (2) για την διάτρηση της περιοχής στόχου και εισχωρήστε με κατεύθυνση μέσα
στον ιστό. Το βάθος της εισχώρησης είναι δυνατό να αναγνωσθεί από τις ενδείξεις πάνω στην κάνουλα όταν
τοποθετείτε την άκρη της κάνουλας.
7. Ελέγξτε τη θέση της άκρης της κάνουλας με την χρήση κατάλληλων τεχνικών απεικονισμού και προσαρμόστε,
αν είναι απαραίτητο.
8. Τοποθετήστε τον ενδείκτη πόρπης (1) ωθώντας το έμβολο έγχυσης (3) προς τα εμπρός όσο το δυνατόν
περισσότερο.
9. Επιβεβαίωστε και καταγράψτε τη θέση του ενδείκτη πόρπης (1).
10. Αφαιρέστε την κάνουλα (2).
11. Περιποιηθείτε το σημείο που προκλήθηκε η πληγή.
12. Μετά τη χρήση: Να απορρίπτεται κατάλληλα η συσκευή εφαρμογής, ακολουθώντας εσωτερικές κατευθυντήριες
γραμμές και οδήγιες, αν χρειάζεται. Μολαταύτα, τουλάχιστον ένας κατάλληλος περιέκτης προορισμένος για
μολυσμένες κάνουλες θα πρέπει να πάρεχεται για την εξασφάλιση της ασφαλούς απόρριψης.
Προειδοποίηση:
Η εταιρεία SOMATEX δεν αναλαμβάνει καμία ευθύνη για τη χρήση αυτής της διάταξης ή οποιουδήποτε στοιχείου
της σε περίπτωση επαναποστείρωσης ή επαναχρησιμοποίησης. Η συγκεκριμένη διάταξη δεν επιτρέπεται να
επαναχρησιμοποιηθεί εφόσον έχει ήδη χρησιμοποιηθεί. Η ποιότητα των υλικών, των επιστρώσεων και των
κολλημένων ενώσεων θα μπορούσε να υποβαθμισθεί. Δεν διασφαλίζεται πλέον η ασφαλής χρήση. Η διάταξη δεν
είναι σχεδιασμένη για τις απαιτούμενες διαδικασίες καθαρισμού και αποστείρωσης μετά την πρώτη χρήση της.
Συνεπώς δεν διασφαλίζεται η στειρότητα των επανεπεξεργασμένων διατάξεων μίας χρήσης. Ο κίνδυνος
ανεπιθύμητων τραυματισμών και λοιμώξεων, ιδίως της μετάδοσης λοιμώξεων μεταξύ ασθενούς και ιατρικού
προσωπικού αυξάνεται σε μη αποδεκτό επίπεδο.
Οδηγίες φύλαξης:
Διατηρείτε στεγνό.
Φυλάσσετε προστατευμένο από την ηλιακή ακτινοβολία και τη θερμότητα (θερμοκρασία 5 – 30 °C).
Οποιοδήποτε τυχόν σοβαρό περιστατικό που προκύψει σε σχέση με το προϊόν θα πρέπει να αναφέρεται στην
SOMATEX Medical Technologies GmbH ("Ιατρικές Τεχνολογίες SOMATEX GmbH"), καθώς και στην αρμόδια
εθνική αρχή.

Tumark®Q 15/72 IT - ITALIANO
30°C
5°C
I T - I T AL I AN O
Leggere le istruzioni prima dell'uso Conservarle come riferimento per il futuro
Informazioni importanti:
Prima dell'uso, leggere attentamente il presente manuale di istruzioni e acquisire familiarità con il suo contenuto.
La mancata lettura dell'intero manuale e la mancata familiarizzazione con tutte le istruzioni prima dell'uso di
Tumark®Q possono compromettere la sicurezza e provocare lesioni gravi o potenzialmente fatali al paziente o
all'operatore e il danneggiamento o il malfunzionamento del dispositivo.
Destinazione d'uso e Indicazione:
Tumark®Q è destinato alla marcatura di tessuto molle come ad esempio il tessuto mammario.
Le sue aree di applicazione includono la marcatura di lesioni prima o durante la chemioterapia, la marcatura del
sito di una biopsia o di un tumore rimosso oppure prima di una radioterapia per una migliore pianificazione del
trattamento.
Controindicazioni:
Tumark®Q non è indicato per usi diversi da quelli descritti qui sopra.
La cannula del Tumark®Q non è idonea all'utilizzo con la risonanza magnetica per immagini (MRI).
Tumark®Q è controindicato in pazienti con gravi allergie al nichel.
Un riepilogo delle prestazioni cliniche e di sicurezza in conformità con l'articolo 32 del Regolamento
2017/745 (prodotti impiantabili) è disponibile su www.somatex.de.
Avvertenze:
Tumark®Q deve essere utilizzato esclusivamente da medici qualificati con conoscenza, esperienza e
formazione nella marcatura percutanea dei tessuti molli.
Il presente manuale non contiene descrizioni o istruzioni relative alle tecniche chirurgiche. È responsabilità del
medico che esegue la procedura determinare l'idoneità della procedura da eseguire e dell'uso di questo
dispositivo e stabilire la tecnica specifica da adottare per il singolo paziente.
Quando si impianta un marcatore a clip vicino a un impianto mammario, fare attenzione a non bucare l'impianto
mammario.
Prima di aprire, assicurarsi che la confezione sia integra e non danneggiata, che sia entro la data di scadenza.
La sterilità del prodotto è garantita solo se questi criteri sono rispettati. Se la confezione è danneggiata o aperta,
non utilizzare il prodotto e contattare il distributore o il produttore, SOMATEX.
Il prodotto è monouso: NON riutilizzare o sterilizzare nuovamente.
Quanto si utilizza un ago di posizionamento, controllare preventivamente la compatibilità Tumark®Q. La punta
smussata della cannula Tumark®Q dovrebbe sporgere interamente dall'ago di posizionamento e l'utilizzatore
dovrebbe essere in grado di valutare la sporgenza per applicare in modo sicuro il marcatore a clip non
posizionandolo quindi troppo all'interno del tessuto.
Precauzioni:
Il marcatore a clip Tumark®Q è realizzato in lega di nichel-titanio (Nitinol), ed è per questo che è controindicato
in pazienti con una grave allergia al nickel.
Verificare che il pulsante a scorrimento resti in posizione retratta mentre si posiziona la cannula.
Per collocare il marcatore di clip, il pulsante a scorrimento deve essere spinto il più vicino possibile alla posizione
di arresto.
C'è rischio di lesioni a causa della punta affilata della cannula. Prestare attenzione, specialmente quando si
apre la confezione della cannula.
Tumark®Q NON è costruito con metalli compatibili con la MRI. NON adatto per la zona di sicurezza MRI.
Pericolo di lesioni!
Prestare attenzione alle dimensioni del marcatore a clip per ciò che concerne l'area del tessuto da marcare
(vedere Descrizione Prodotto).
In rari casi, è possibile che l’espansione del marcatore di clip venga ritardata. La visibilità nelle immagini
radiologiche potrebbe essere compromessa fino all’intera espansione.
Informazioni sui materiali utilizzati:
Il marcatore a clip impiantabile è realizzato in lega di nichel-titanio (Nitinol).
Informazioni di sicurezza RM del sistema di applicazione (cannula con impugnatura):
Non sicuro
per la RM
La cannula di Tumark®Q sistema di applicazione è in contrasto con il marcatore di clip non
adatto all'uso nella RM.
Tumark®Q 16/72 IT - ITALIANO
30°C
5°C
Informazioni di sicurezza RM del marcatore a clip:
MR
Condizionale
Il marcatore a clip è conditionalement compatibile con RM. Il paziente può essere sottoposto a una
procedura RMI sicura con il marcatore, alle seguenti condizioni:
campo magnetico statico fino a 3,0 T con
tasso di assorbimento specifico (SAR) massimo mediato sul corpo intero (WBA) teoricamente
stimato di 2 W/kg.
Test non clinici sono stati eseguiti sui seguenti sistemi:
1,5 Tesla Siemens Magnetom Avanto (Siemens Medical, Erlangen, Germania) RM con software Numaris 4,
syngo MR (Versione “B13, N4_VB13A_LATEST_20060607_P29”).
3 T Siemens Magnetom Skyra (Siemens Medical, Erlangen, Germania) RM con software Numaris 4, syngo
MR (Versione “D11, N4_VB11D_LATEST_20110129_P3”);
Alle condizioni di scansione suddette, si prevede che il marcatore a clip di Tumark®Qprodurrà il seguente aumento
massimo della temperatura associato alle RF:
a 1,5 T: < 1,0 °C (2 W/kg SAR) dopo 20 minuti di scansione continua,
a 3,0 T: < 1,0 °C (2 W/kg SAR) dopo 20 minuti di scansione continua.
Alle condizioni di scansione suddette, si prevede che il marcatore a clip di Tumark®Q produrrà i seguenti artefatti:
a 1,5 T: sequenza spin echo 4,3 mm; sequenza gradiente echo 3,2 mm;
a 3,0 T: sequenza spin echo 4,7 mm; sequenza gradiente echo 4,0 mm.
Non esporre il marcatore a clip impiantato a tecniche di RMI non convenzionali e non standardizzate,
diverse da quelle elencate qui sopra, in quanto NON È STATO TESTATO per tali scopi.
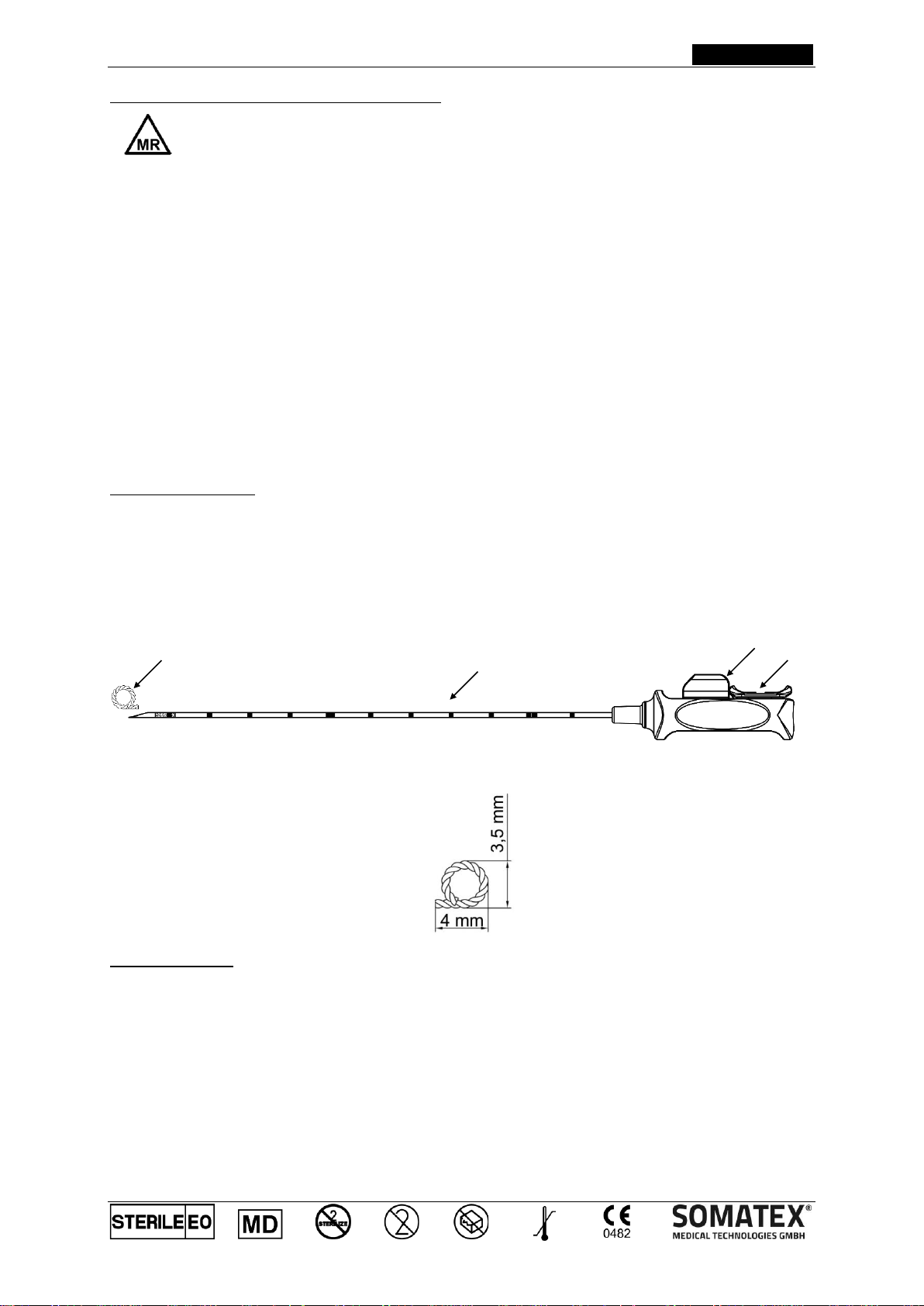
Descrizione Prodotto:
Tumark®Q è un sistema di marcatura di siti tissutali precaricato, sterile, monouso, composto da un marcatore non
assorbibile in nichel-titanio (1), una cannula di introduzione (2) e un’impugnatura in plastica. Nelle condizioni di
forntiura, il marcatore a clip è contenuto all'interno della cannula. La punta della cannula è smussata per facilitarne
l'inserimento, inoltre ci sono dei segni a intervalli di 1 cm per misurare la profondità di penetrazione e una superficie
ruvida dietro la punta della cannula. Il marcatore a clip può essere posizionato spingendo in avanti con una mano
il cursore dell'impugnatura di plastica (3) dopo aver rimosso la clip di fissaggio (4). Un sistema con fermo di
sicurezza impedisce che il pulsante a scorrimento possa essere involontariamente spinto in avanti, evitando così il
rischio di impianto prematuro del marcatore. Il marcatore a clip ha una forma Q (1).
Rappresentazione schematica
Dimensioni del marcatore a clip
Istruzioni per l'uso:
1. Prima di aprire, assicurarsi che la confezione sia integra e non danneggiata, che sia entro la data di scadenza.
2. Disinfettare il punto di iniezione e, se necessario, coprire l'area con salviette sterili.
3. Utilizzare metodi di imaging idonei (ultrasuono, mammografia) per identificare la zona d'interesse. NOTA: la
cannula Tumark®Q non è idonea alla fascia di sicurezza MRI.
4. Aprire il prodotto e rimuoverlo dalla confezione.
5. Rimuovere la clip di fissaggio (4) dall'impugnatura e Rimuovere la clip di fissaggio dall'impugnatura ed estrarre
il flessibile protettivo dall'attaccatura della cannula con un movimento rotatorio.
6. Utilizzare la cannula (2) per perforare la zona d'interesse e inserirla nel tessuto. La profondità può essere letta
dai segni sulla cannula al momento del posizionamento.
7. Controllare la posizione della punta della cannula utilizzando tecniche di imaging idonee e modificarla se
necessario.
8. Posizionare il marcatore a clip (1) spingendo lo stantuffo (3) fino in fondo.
9. Verificare e registrare la posizione del marcatore a clip (1).
10. Rimuovere la cannula (2).
2
3
4
1

Tumark®Q 17/72 IT - ITALIANO
30°C
5°C
11. Medicare la ferita.
12. Dopo l'uso: smaltire il dispositivo in modo idoneo, seguendo le linee guida interne se necessario. Dovrebbe
tuttavia essere fornito almeno un contenitore per le cannule contaminate per assicurare uno smaltimento
sicuro.
Avvertenza:
SOMATEX non assume alcuna responsabilità per l'uso di questo dispositivo o dei suoi componenti in caso di
risterilizzazione o di riutilizzo. Questo dispositivo non può essere riutilizzato dopo l'uso. La qualità dei materiali, dei
rivestimenti e delle giunzioni adesive può alterarsi. L'uso sicuro non è più garantito. Il dispositivo non è studiato per
essere sottoposto ai processi di pulizia e di sterilizzazione necessari dopo l'uso. Pertanto, la sterilità dei prodotti
monouso rigenerati non è garantita. Il rischio di lesioni e infezioni non volute aumenta in modo inaccettabile, in
particolare quello di infezioni crociate fra il paziente e lo staff medico.
Istruzioni di conservazione:
Mantenere asciutto.
Tenere lontano da luce solare e calore (temperatura compresa tra 5 e 30 °C).
Qualsiasi evento grave relativo al prodotto deve essere segnalato a SOMATEX Medical Technologies GmbH e
all'autorità nazionale competente.

Tumark®Q 18/72 PT - PORTUGUÊS
30°C
5°C
PT - PO RTUG UÊS
Leia as instruções antes da utilização Guarde as instruções para futura referência
Informações Importantes:
Leia este manual de instruções e familiarize-se com o seu conteúdo antes da utilização. A falta de leitura deste
manual e o familiarização com as instruções antes de utilizar o Tumark®Q poderá provocar lesões graves ou
mortais no doente ou no utilizador e resultar em danos ou na avaria do dispositivo.
Utilização a que se destina e Indicações:
A Tumark®Q destina-se à marcação de tecido macio, como tecido do peito.
Entre as suas áreas de aplicação estão a marcação de lesões antes ou depois de quimioterapia, a marcação do
local de uma biópsia ou de um tumor removido, ou antes de uma radiografia para planear melhor o tratamento.
Contraindicações:
O Tumark®Q destina-se apenas à utilização indicada acima.
A cânula Tumark®Q não deve ser usada com imagem por ressonância magnética (MRI).
A Tumark®Q está contra-indicada para doentes com alergia grave ao níquel.
Encontra-se disponível um resumo do desempenho clínico e de segurança, em conformidade com o Artigo
32.º do Regulamento 2017/745 (dispositivos implantáveis), em www.somatex.de.
Advertências:
Apenas médicos qualificados, com conhecimento, experiência e formação na marcação de tecidos moles
percutâneos, devem utilizar o Tumark®Q.
Este manual não inclui descrições ou instruções sobre técnicas cirúrgicas. É da responsabilidade do médico
que realiza qualquer procedimento determinar a adequação do tipo de procedimento a ser realizado e a
utilização deste produto, bem como determinar a técnica específica para cada doente.
Ao implantar um marcador de clipe próximo de um implante mamário, manuseie o mesmo com cuidado para
não perfurar o implante mamário.
Antes da abertura, certifique-se de que a embalagem não se encontra aberta ou danificada, que se encontra
dentro do prazo de validade. A esterilidade do produto apenas pode ser garantida se estes critérios forem
cumpridos. Se a embalagem estiver danificada ou aberta antes da abertura, o produto não deve ser usado e o
distribuidor ou o fabricante, SOMATEX, devem ser contactados.
O produto destina-se a ser usado uma única vez: NÃO reutilizar nem esterilizar novamente.
Quando for utilizada uma agulha de posicionamento, a compatibilidade da Tumark®Q terá de ser verificada
previamente. A ponta biselada da cânula Tumark®Q deverá sair totalmente para fora da agulha de
posicionamento, e o utilizador deverá conseguir medir esta protrusão para poder aplicar o marcador de clipe
de forma segura e não o colocar demasiado para dentro do tecido.
Precauções:
O marcador de clipe da Tumark®Q é feito de uma liga de níquel-titânio (Nitinol), razão pela qual o produto é
contra-indicado em pacientes com alergia grave ao níquel.
O controle deslizante deve permanecer na posição retraída enquanto a cânula está sendo posicionada.
O marcador de clipe deve ser posicionado, empurrando o botão deslizante para a frente tanto quanto possível
até à posição final.
Existe um risco de lesão devido à ponta afiada da cânula. Tenha especial cuidado ao desembalar a cânula.
A cânula da Tumark®Q NÃO é fabricada com metais compatíveis com imagiologia por ressonância magnética
(IRM). NÃO é adequada para IRM. Perigo de lesão!
Preste atenção às dimensões do marcador de clipe em relação ao tamanho da área do tecido a ser marcada
(ver Descrição do Produto).
Em casos raros, a expansão do marcador de clipe poderá demorar. A visibilidade no exame radiológico poderá
ser comprometida até a expansão estar completa.
Informação sobre materiais utilizados:
O marcador de clipe implantável é de uma liga de níquel-titânio (Nitinol).
Sistema de aplicação das Informações de Segurança para IRM (cânula com pega):
Não adequado para
Ressonância Magnética
Ao contrário do marcador de clipe, o dispositivo de aplicação da cânula Tumark®Q não é
apropriado para utilização num scanner de ressonância magnética.

Tumark®Q 19/72 PT - PORTUGUÊS
30°C
5°C
Clipe marcador Informações de Segurança para IRM:
MR condicional
O marcador de clipe é condicionalmente seguro de ressonância magnética. Um doente
pode ser submetido em segurança a um procedimento MRI com um marcador sob as
seguintes condições:
campo magnético estático até 3,0 T com
taxa de absorção específica (SAR, do inglês specific absorption rate) ponderada de
corpo inteiro máxima estimada teoricamente de 2 W/kg.
Foram realizados ensaios não clínicos nos seguintes sistemas:
1,5 T Siemens Magnetom Avanto (Siemens Medical, Erlangen, Alemanha) IRM com software Numaris 4, syngo
MR (Versão “B13, N4_VB13A_LATEST_20060607_P29”).
3 T Siemens Magnetom Avanto (Siemens Medical, Erlangen, Alemanha) IRM com software Numaris 4, syngo
MR (Versão “D11, N4_VB11D_LATEST_20110129_P3”);
Nas condições de examedefinidas acima, espera-se que o clipe marcador Tumark®Q produza o seguinte aumento
máximo de temperatura de radiofrequência:
a 1,5 T: < 1,0 °C (2 W/kg SAR) ao fim de 20 min de exame contínuo,
a 3,0 T: < 1,0 °C (2 W/kg SAR) ao fim de 20 min de exame contínuo.
Nas condições de exame acima definidas, espera-se que o clipe marcador Tumark®Q produza os seguintes
artefactos de imagem:
a 1,5 T: sequência spin eco de 4,3 mm; sequência gradiente eco de 3,2 mm;
a 3,0 T: sequência spin eco de 4,7 mm; sequência gradiente eco de 4,0 mm.
Não exponha o marcador de clipe implantado a outras técnicas de IRM não convencionais e não
normalizadas para além das acima enumeradas, pelo facto de NÃO TER SIDO TESTADO para esse efeito.
Descrição do Produto:
Trata-se de um produto estéril para utilizar uma única vez. O Tumark®Q é um sistema de marcação de tecidos
estéril, de uma única utilização e pré-carregado, composto por um marcador de clipe não absorvível em níquel-
titânio (1), uma cânula de introdução (2) e uma pega de plástico. Se for novo e não estiver aberto, o marcador de
clipe encontra-se dentro da cânula. A ponta da cânula é biselada para ajudar a inserção, possuindo marcações
com afastamento de 1 cm para medir a profundidade da penetração e uma superfície texturada para além da ponta
da cânula. O marcador de clipe pode ser colocado com a mão, empurrando para a frente a peça deslizante na
pega de plástico (3) depois de o clipe de fixação (4) ter sido retirado. Um sistema de bloqueio de segurança evita
que o botão deslizante se mova inadvertidamente para a frente, impedindo a aplicação prematura do marcador. O
marcador de clipe apresenta uma forma Q (1).
representação esquemática
dimensões do marcador de clipe
Indicações de Utilização:
1. Antes da abertura, certifique-se de que a embalagem não se encontra aberta ou danificada, que se encontra
dentro do prazo de validade.
2. Desinfete o local de injeção e, sendo apropriado, cubra a área com toalhetes estéreis.
3. Utilize métodos de imagiologia adequados (ecografia, mamografia) para identificar a área alvo. NOTA: a
cânula Tumark®Q não é adequada para a zona de segurança de MRI.
4. Abra o produto e retire da embalagem.
5. Remova o clipe de fixação (4) da pega e retire a cânula exterior, torcendo-a a partir da base.
6. Utilize a cânula (2) para efetuar a punção da zona alvo e insira no tecido. A profundidade da inserção pode
ser lida a partir das marcações na cânula ao posicionar a ponta da cânula.
2
3
4
1

Tumark®Q 20/72 PT - PORTUGUÊS
30°C
5°C
7. Verifique a posição da ponta da cânula usando técnicas de imagiologia adequadas e, sendo o caso, proceda
aos ajustamentos necessários.
8. Coloque o marcador de clipe (1), empurrando o êmbolo (3) para a frente até onde este conseguir avançar.
9. Verifique e registe a posição do marcador de clipe (1).
10. Retire a cânula (2).
11. Trate o local da ferida.
12. Após a utilização: elimine corretamente o dispositivo da aplicação, seguindo as orientações internas, quando
apropriado; no entanto, deve ser disponibilizado pelo menos um recipiente destinado a cânulas contaminadas
para garantir uma eliminação segura.
Atenção:
A empresa SOMATEX não assume qualquer responsabilidade pela utilização deste produto ou dos seus
componentes em caso de reesterilização ou reutilização. Este dispositivo poderá não ser reutilizado após ter sido
utilizado uma vez. A qualidade dos materiais, revestimentos e juntas adesivas poderá degradar-se. A utilização
segura do dispositivo já não poderá ser garantida. O dispositivo não foi concebido para os processos de limpeza
e esterilização necessários após ter sido utilizado uma vez. A esterilidade dos produtos descartáveis
reprocessados de uma única utilização não é garantida. O risco de lesões e infeções indesejadas, sobretudo
infeções cruzadas entre doentes e equipa médica, aumenta para um nível considerado inaceitável.
Instruções de Armazenamento:
Mantenha o dispositivo seco.
Proteja o dispositivo da luz solar e do calor (temperatura entre 5 e 30 ºC).
Qualquer situação grave que ocorra em relação ao produto deve ser reportada à SOMATEX Medical Technologies
GmbH, assim como à autoridade nacional competente.
This manual suits for next models
1
Table of contents
Languages:
Other Somatex Medical Equipment manuals

Somatex
Somatex Tumark Vision MRI User manual

Somatex
Somatex CT-Eye-ProteX User manual

Somatex
Somatex SurgLite SL0200-15 User manual

Somatex
Somatex Tumark MRI User manual

Somatex
Somatex Tumark Vision User manual

Somatex
Somatex TUMARK Professional User manual
Somatex
Somatex Tumark Eye User manual

Somatex
Somatex VERTEBROPLASTY User manual