ES
Instrucciones abreviadas para el sistema de
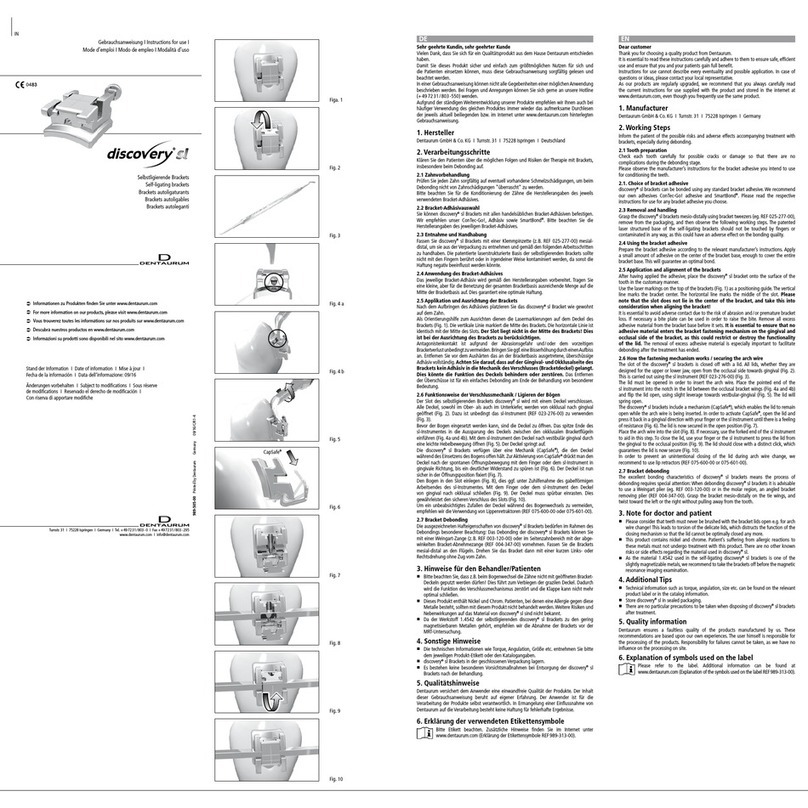
implantes tioLogic
®
1. Fabricante
Dentaurum Implants GmbH I Turnstr.31 I 75228 Ispringen I Alemania
2. Descripción breve
Los implantes tioLogic
®
están concebidos para la inserción endoósea en el maxilar supe-
rior y la mandíbula. Sobre los implantes se fijan los correspondientes aditamentos trans-
gingivales, según indicación,y se rehabilitan con una supraestructura protética.
Para la inserción y rehabilitación protética de los implantes el sistema de implantes tioLo-
gic
®
incluye instrumentos, pilares y componentes accesorios que armonizan especialmen-
te entre sí. Únicamente se podrán combinar entre ellos los componentes originales del
sistema de implantes tioLogic
®
siguiendo las indicaciones especificadas en las instruccio-
nes / los manuales de uso.
3. Indicaciones
Los implantes tioLogic
®
pueden colocarse tanto en la mandíbula, como también en el
maxilar superior para la implantación quirúrgica inmediata, la implantación inmediata
retrasada y la implantación tardía, tanto en una sola fase, como en dos fases. Los casos
indicados para el maxilar superior y la mandíbula son pequeñas y grandes edentaciones
intercaladas (restitución de dientes unitarios, aumento de pilares), arcada disminuida y
maxilares edéntulos. La decisión en este caso deberá tomarse evaluando los riesgos, las
ventajas y desventajas de la implantación, así como los métodos de tratamiento alterna-
tivos.
En cada caso implantológico, el diámetro y la longitud de los implantes tioLogic
®
deberán
encontrarse en una relación proporcional a la rehabilitación protética. Las rehabilitaciones,
que ejercen una elevada carga mecánica sobre los implantes y la supraestructura, deberán
– cuando la situación personal del paciente lo permita – realizarse siempre con diámetros
de implante mínimos de 4.2 mm.
Para las indicaciones con un reducido ancho de hueso vestíbulo-bucal, están disponibles
los implantes tioLogic
®
S de ø 3.3 mm. Debido a su menor diámetro y resistencia (en
comparación p.ej. con los implantes tioLogic
®
M de ø 4.2 mm) tienen un abanico de
indicaciones restringido. En el maxilar edéntulo deberán insertarse como mínimo cuatro
implantes tioLogic
®
S de ø 3.3 mm para una rehabilitación con una barra ferulizada sin
prolongación. En el maxilar parcialmente edéntulo deberán combinarse con implantes
tioLogic
®
de ø 4.2 mm o ø 4.8 mm o ø 5.5 mm para rehabilitaciones implantosoportadas
y el trabajo protético deberá ser fijo y ferulizado. En la rehabilitación con coronas unitari-
as los implantes tioLogic
®
S de ø 3.3 mm únicamente deberán utilizarse para los incisivos
inferiores o los incisivos laterales superiores y con una longitud mínima de 11.0 mm.
Rehabilitaciones unitarias en implantes
tioLogic
®
de ø 3.7 mm, ø 4.2 mm, ø 4.8 mm y ø 5.5
mm requieren una longitud de implante mínima de 9.0 mm. Al usar pilares de bola junto
con implantes de ø 3.3 mm es necesario evitar una carga mecánica demasiado alta de
los implantes.
4. Contraindicaciones
Implantes de ø 3.3 mm no se recomiendan para restauraciones de incisivos centrales
aislados en el maxilar superior, así como caninos, premolares y molares aislados en el
maxilar superior y en la mandíbula. No se permiten construcciones dobles sobre estos
implantes. En casos de divergencias de implantes de más de 10° por implante no se
recomienda el uso de pilares LOCATOR
®
.
Contraindicaciones generales:
Deberán tenerse en cuenta las contraindicaciones generales para intervenciones quirúrgi-
cas en el campo odontológico. Entre otras, son: Reducción de la defensa inmunológica /
terapia con esteroides / alteraciones en la coagulación de la sangre / enfermedades sin
control / enfermedades reumáticas / enfermedades del sistema óseo / cirrosis del hígado
/ consumo abusivo de drogas, alcohol o tabaco / depresiones, psicopatías / cooperación
insuficiente por parte del paciente / enfermedades inflamatorias subyacentes de carácter
crónico.
Contraindicaciones locales / personales:
Osteomielitis / radioterapia en la zona craneal / enfermedades recidivas de la mucosa bucal
/ higiene bucal insuficiente / molestias en las ATM / parafunciones / falta de oferta ósea
vertical/horizontal / defectos maxilares/mandibulares / calidad ósea insuficiente / higiene
bucal insuficiente
5. Observaciones adicionales
Los implantes dentales se insertan con unas tasas de éxito elevadas y presentan una larga
vida útil. No obstante, no es posible garantizar un tratamiento exitoso. Estos casos no
exitosos deberán ser reconocidos por el operador, documentándose e informando de ello
al fabricante.
Un número insuficiente de implantes, longitudes y diámetros inadecuados, un posiciona-
miento poco ventajoso de los implantes, así como una rehabilitación protética estática-
mente desfavorable, pueden provocar fracturas por fatiga en los implantes, los pilares y
los tornillos protéticos bajo cargas biomecánicas. La colocación de los implantes y la ela-
boración de la rehabilitación protética deberán realizarse teniendo en cuenta la situación
individual del paciente, para evitar una sobrecarga de los componentes utilizados.
También la utilización de componentes del sistema de implantes tioLogic
®
que según las
instrucciones de uso / los manuales de procedimiento no se declaran explícitamente como
combinables entre ellos, puede provocar el fracaso mecánico, daños en los tejidos o bien
unos resultados estéticos insatisfactorios.
No se tiene conocimiento de efectos secundarios ni de interacciones causadas por los
implantes tioLogic
®
. Sin embargo, no puede descartarse que en casos aislados puedan
manifestarse alergias contra los componentes de los materiales utilizados en el sistema de
implantes tioLogic
®
o bien sensaciones de malestar de origen electroquímico.
6. Envase y esterilidad
Todos los implantes tioLogic
®
se suministran sueltos con sus correspondientes tornillos de
cierre en un doble envase esterilizado por rayos gamma (bolsa y envase blíster) que pro-
tege contra la contaminación el contenedor interior. El doble envase queda protegido
adicionalmente por un envase exterior. El contenido únicamente es estéril con el envase
intacto. En caso que el doble envase presentara daños, el producto no deberá utilizarse.
Los implantes tioLogic
®
están previstos exclusivamente para un uso único.
El resto de componentes del sistema de implantes tioLogic
®
se suministran sin esterilizar.
Los componentes quirúrgicos deberán desinfectarse, limpiarse y esterilizarse cuidadosa-
mente antes de su uso. Esto es especialmente válido para los componentes desmontables
como p. ej. la carraca dinamométrica.
7. Utilización / Disponibilidad / Medidas de precaución / Documentación
El programa de productos tioLogic
®
se entrega exclusivamente a médicos, odontólogos y
protésicos dentales. Sólo debe ser utilizado por médicos, odontólogos y protésicos denta-
les familiarizados con la implantología odontológica, incluyendo el diagnóstico, la planifi-
cación prequirúrgica, el protocolo quirúrgico y la rehabilitación protética.
Antes de su uso el usuario deberá asegurarse de que ha repasado y entendido
escrupulosamente todas las instrucciones de uso / los manuales de procedimiento tioLo-
gic
®
. Las presentes instrucciones abreviadas no sustituyen las instrucciones de uso / los
manuales para el sistema de implantes tioLogic
®
. Ya que las instrucciones de uso y los
manuales no pueden proporcionar todas las informaciones para un uso inmediato, se
recomienda insistentemente la asistencia a uno de los cursos de formación continuada
ofrecidos por Dentaurum Implants sobre el sistema tioLogic
®
para adquirir las técnicas
adecuadas, antes de proceder a su utilización.
Las medidas de precaución y la selección de componentes para el procedimiento clínico
se detallan en el Catálogo de Productos y los Manuales de Cirugía.
Las medidas de precaución y la selección de componentes para el procedimiento pro-
tésico se detallan en el Catálogo de Productos y los Manuales de Cirugía.
Es responsabilidad del usuario examinar e informar a fondo al paciente antes de utilizar
este producto. Dentaurum Implants recomienda realizar una completa documentación
clínica, radiológica, fotográfica y estadística.
Los componentes del sistema de implantes tioLogic
®
pueden documentarse p. ej. en la
ficha del paciente o en el carnet del paciente con la ayuda de las etiquetas adicionales.
Para el uso intrabucal los productos deberán asegurarse con el fin de evitar su aspiración
por parte del paciente.
No todos los componentes están disponibles en todos los países.
8. Calidad / Garantía y responsabilidad / Desarrollo
El desarrollo, la comprobación clínica, la fabricación y el control de calidad de la gama de
productos tioLogic
®
se realizan según la Directiva de Productos Sanitarios 93/42/CEE.
En caso de garantía y responsabilidad tendrán vigencia – exceptuando las reglamentaci-
ones especiales indicadas en esta descripción breve – los párrafos 9 y 10 de nuestras
Condiciones generales de suministro y pago.
Existirá una exención de responsabilidad particularmente en el caso de un uso no adecu-
ado de los productos por parte del usuario o terceros; esto también es válido para una
combinación del programa de productos tioLogic
®
con productos ajenos, cuyo uso no haya
sido expresamente recomendado por Dentaurum Implants.
La manipulación y el uso del producto tienen lugar fuera del control de Dentaurum
Implants y son responsabilidad única del usuario.
El asesoramiento en las técnicas de aplicación (oral y escrito) se realiza según el nivel
actual de la ciencia y la técnica, conocido en el momento de poner en circulación el pro-
ducto. No exime al usuario de la obligación de verificar por cuenta propia la idoneidad de
los productos para la indicación y los usos previstos. Se trata únicamente de recomenda-
ciones sin compromiso, de las cuales no pueden derivarse seguridades o garantías de tipo
alguno.
Todos los productos están sometidos a un perfeccionamiento constante teniendo en
cuenta el estado actual de conocimientos científicos – reservado el derecho a modificar la
construcción, el diseño y el material.
9. Explicación de los símbolos utilizados en las etiquetas
Por favor observe la etiqueta. Más indicaciones se hallan en internet en
www.dentaurum-implants.com (Explicación de los símbolos utilizados en las
etiquetas REF 989-313-00).
IT
Brevi istruzioni d‘uso sistema implantare tioLogic®
1. Produttore
Dentaurum Implants GmbH I Turnstr.31 I 75228 Ispringen I Germania
2. Breve descrizione
I tipi di impianto tioLogic
®
sono stati concepiti per l‘inserzione endossale nel mascellare
superiore e in quello inferiore. Sugli impianti, secondo le diverse indicazioni, vengono
fissati i relativi monconi transgengivali portanti la ricostruzione protesica.
Per l‘inserzione e la ricostruzione protesica, nel sistema implantare tioLogic
®
sono
disponibili vari strumenti, monconi e accessori perfettamente calibrati tra loro. Possono
essere combinati tra loro esclusivamente i componenti originali del sistema implantare
tioLogic
®
, secondo le indicazioni descritte nel manuale/ istruzioni per l‘uso.
3. Indicazioni
I tipi di impianto tioLogic
®
possono essere impiegati sia nell’arcata superiore che in
quella inferiore, per impianti a carico immediato e impianti a carico ritardato, ad una o due
fasi. Le indicazioni d‘uso riguardano le piccole o grandi zone edentule superiori ed inferiori
(corone singole, aumento dei monconi pilastro), arcate dentali ridotte ed edentulia
totale. L’indicazione all’impianto deve essere presa tenendo conto dei vantaggi e degli
svantaggi nonché dei rischi del trattamento implantare e delle terapie alternative.
Per ogni singolo caso clinico, il diametro e la lunghezza degli impianti tioLogic
®
devono
essere proporzionati alla ricostruzione protesica. Le ricostruzioni protesiche che esercitano
un elevato carico meccanico sugli impianti e sulla sovrastruttura, devono essere realizzate,
se la situazione individuale del paziente lo permette, solamente utilizzando impianti con
un diametro minimo di 4,2 mm.
Per indicazioni con una ridotta larghezza ossea vestibolo-linguale,sono disponibili i tipi di
impianto tioLogic
®
da ø 3.3 mm – S. Grazie al loro piccolo diametro e alla loro ridotta
resistenza al carico (se paragonati ai tipi di impianto tioLogic
®
da ø 4.2 mm – M), questi
hanno una limitata indicazione d‘uso. In un’arcata edentula devono essere inseriti
almeno 4 tipi di impianto tioLogic
®
S da ø 3.3 mm bloccati tra loro con una barra
senza estensioni. In un’arcata con pochi denti residui, le ricostruzioni su impianti
devono essere combinate su tipi di impianto tiologic
®
da ø 4.2 mm o da ø 4.8 mm
o da ø 5.5 mm e bloccate in modo permanente.
Per riabilitazioni di corone singole devono essere inseriti i tipi di impianto tioLogic
®
S da
ø 3.3 mm e usati solamente per gli incisivi inferiori o per i laterali superiori e solo lunghi
11.0 mm. Per riabilitazioni di corone singole su tipi di impianto tioLogic
®
da ø 3.7 mm,
da ø 4.2 mm, da ø 4.8 mm e da ø 5.5 mm deve essere presa in considerazione una
lunghezza minima di 9.0 mm. Quando si utilizzano gli abutment a sfera su impianti da
ø 3.3 mm è necessario evitare di caricare troppo gli impianti.
4. Controindicazioni
Gli impianti da ø 3,3 mm non sono adatti per centrali singoli superiori né per canini,
premolari e molari superiori e inferiori. Strutture di due corone non sono consentite su
questi impianti. Con divergenze implantari superiore a 10° per impianto l'uso di abutment
LOCATOR
®
è controindicato.
Controindicazioni generali:
Per la fase chirurgica devono essere considerate le controindicazioni generali e, tra queste,
in particolare: la ridotta resistenza del sistema immunitario, la terapia con steroidi, i
disturbi di coagulazione sanguigna, le malattie endocrinali non controllate, le malattie
reumatiche, le malattie del sistema osseo, la cirrosi epatica, l’abuso di droghe, alcol o
tabacco, la depressione, le psicopatie, la non collaborazione del paziente, situazioni
infiammatorie croniche.
Controindicazioni locali / Controindicazioni personali:
Osteomielite, radioterapia del cranio, malattie recidive della mucosa orale, disturbi
della articolazione temporomandibolare, parafunzioni, mancanza verticale ed orizzontale
del tessuto osseo, difetti mascellari e mandibolari, qualità ossea insufficiente, igiene
orale insufficiente.
5. Ulteriori avvertenze
Gli impianti dentali vengono inseriti con un‘alta percentuale di successo ed hanno una
lunga durata. Ciò nonostante il successo del trattamento non può essere garantito.
L‘utilizzatore deve riconoscere e documentare questi casi e renderli noti al fabbricante.
Un numero insufficiente di impianti, la loro insufficiente lunghezza e diametro, il
posizionamento sfavorevole degli stessi, come pure la ricostruzione protesica con statica
non corretta, sotto il carico biomeccanico può provocare la rottura per affaticamento del
materiale, degli impianti, dei monconi e delle viti protesiche. Per evitare un sovraccarico
meccanico dei componenti utilizzati, è necessario che il posizionamento degli impianti e
la successiva realizzazione della protesi dentale avvengano nel rispetto della situazione
individuale del paziente.
Anche l‘utilizzo di componenti del sistema tioLogic
®
che, secondo le indicazioni contenute
nelle istruzioni d‘uso/manuali, non sono espressamente definiti come combinabili tra loro,
può provocare la rottura meccanica, il danno dei tessuti o un risultato estetico insoddisfacente.
Effetti collaterali o interazioni con i tipi di impianto tioLogic
®
sono sconosciuti. Non è
comunque escluso che, in rari casi eccezionali, si possano verificare allergie contro i
componenti dei materiali utilizzati nel sistema implantare tioLogic
®
o eventuali sensazioni
elettrochimiche sgradevoli.
6. Confezione e sterilità
Tutti i tipi di impianto tioLogic
®
vengono forniti singolarmente con la relativa vite di chiu-
sura in una doppia confezione sterilizzata ai raggi gamma (sacchetto termosigillato e bli-
ster) che protegge il prodotto dalla contaminazione. La doppia confezione è ulteriormente
protetta da un ulteriore imballo. Se la doppia confezione è danneggiata, il prodotto non
deve essere utilizzato, in quanto non può più essere garantita la sterilità del contenuto. Gli
impianti tioLogic
®
sono esclusivamente da intendersi monouso.
Tutti gli altri componenti del sistema implantare tioLogic
®
vengono forniti non sterili.
I componenti chirurgici, prima dell‘uso, devono essere disinfettati, puliti e sterilizzati
accuratamente. Ciò vale specialmente per i componenti smontabili, come per esempio la
chiave dinamometrica.
7. Utilizzo / Disponibilità / Misure precauzionali / Documentazione
I prodotti tioLogic
®
sono indicati solo per medici, odontoiatri e odontotecnici. Possono
essere usati solamente da quegli operatori che abbiano acquisito esperienza in campo
implantare, nonché nella diagnosi, nellla pianificazione preoperativa, nelle procedure
chirurgiche e nella ricostruzione protesica.
Prima dell‘uso, l‘utilizzatore deve aver accuratamente letto e capito tutte le istruzioni
d‘uso/manuali tioLogic
®
. Queste brevi istruzioni non sostituiscono il manuale/ istruzioni
d‘uso per il sistema implantare tioLogic
®
. Prima dell‘uso, si consiglia vivamente
all‘utilizzatore di partecipare ad uno dei corsi di formazione promossi dalla Dentaurum
Implants riguardanti il sistema tioLogic
®
.
Riguardo le misure precauzionali e la scelta dei componenti per la procedura clinica,
vedere al Catalogo prodotti ed al Manuale chirurgico.
Riguardo le misure precauzionali e la scelta dei componenti per la procedura protesica,
vedere al Catalogo prodotti ed al Manuale protesico.
È obbligo dell‘utilizzatore, prima dell‘uso di questo prodotto, visitare ed informare il
paziente. Dentaurum Implants consiglia la raccolta di una completa documentazione
clinica, radiologica, fotografica e statistica.
I componenti del sistema d‘impianti tioLogic
®
possono essere documentati grazie alle
etichette supplementari, per es. nella cartella clinica o nel Passaporto del paziente.
Nell‘uso intraorale, l‘utilizzatore deve proteggere i prodotti nei confronti dell‘aspirazione.
Non tutti i componenti sono disponibili in tutti i Paesi esteri.
8. Qualità / Garanzia e responsabilità / Sviluppo
Lo sviluppo, gli studi clinici, la produzione ed il controllo di qualità del programma di
prodotti tioLogic
®
sono realizzati secondo le direttive per i prodotti medicali 93/42/CEE.
Per la garanzia e la responsabilità sono validi i paragrafi 9 e 10 delle nostre Condizioni di
vendita, salvo diversamente descritto in queste brevi istruzioni per l‘uso.
La garanzia e la responsabilità decadono in caso di uso non corretto del prodotto da parte
dell‘utilizzatore o di una terza persona. Ciò vale anche nel caso di combinazione di
prodotti del programma tioLogic
®
con materiali di altre aziende, procedura espressamente
sconsigliata da Dentaurum Implants.
La lavorazione e l‘uso dei prodotti avviene al di fuori della possibilità di controllo da parte
di Dentaurum Implants GmbH e restano quindi ad esclusiva responsabilità dell‘utilizzatore.
La consulenza tecnica (orale o scritta), è basata secondo l‘ultimo livello scientifico e
tecnologico conosciuto al momento della messa in commercio del prodotto.
Questa non esonera l‘utilizzatore dal dovere di controllo del prodotto per l‘indicazione e
l‘uso previsti. Si tratta, in questo caso, esclusivamente di consigli non vincolanti, dai quali
non può essere dedotta alcuna assicurazione o garanzia.
Tutti i prodotti sono sottoposti a continuo sviluppo, in osservanza dell‘attuale livello
di conoscenza scientifica. Si riserva il diritto di apportare modifiche di costruzione,design
e nei materiali.
9. Spiegazione dei simboli presenti sull‘etichetta
Si prega di osservare quanto riportato sull’etichetta. Ulteriori indicazioni sono
disponibili nel sito internet www.dentaurum-implants.com (Spiegazione dei
simboli presenti sull‘etichetta REF989-313-00).
RU
Краткая инструкция для системы имплантатов
tioLogic
®
1. Изготовитель
Dentaurum Implants GmbH I Turnstr. 31 I 75228 Ispringen I Germany
2. Краткое описание
Типы имплантатов tioLogic
®
разработаны для эндооссальной имплантации на верхней
и нижней челюсти. На имплантаты, в зависимости от показаний, фиксируются соот-
ветствующие трансгингивальные абатменты и проводится протезирование с ортопеди-
ческими супраконструкциями.
Для проведения имплантации и протезирования система имплантатов tioLogic
®
содержит специально подобранные друг к другу инструменты, компоненты абатментов
и комплектующие изделия.
Согласно инструкциям по применению /справочникам разрешается комбинировать
друг с другом исключительно оригинальные компоненты системы имплантатов
tioLogic
®
.
3. Показания
Типы имплантатов tioLogic
®
можно использовать для одноэтапной и двухэтапной
хирургической немедленной, ранней отсроченной и отсроченной имлантации как на
верхней, так и на нижней челюсти.
Областями применения являются небольшие и большие включённые дефекты зубного
ряда верхней и нижней челюсти (протезирование при потере одного зуба, увеличение
числа опор мостовидного протеза), концевой дефект и беззубая челюсть. Показания к
имплантации следует выбирать, учитывая возможные преимущества и недостатки, а
также риски как имплантологического лечения, так и альтернативных методов лечения.
Для каждой имплантации диаметр и длина имплантатов типов tioLogic
®
должны
пропорционально соответствовать протезной конструкции.
Протезам, которые оказывают большую механическую нагрузку на имплантаты и
супраконструкции, следует принципиально опираться, если это допустимо в
индивидуальной ситуации пациента, на имплантаты диаметром как минимум 4,2 мм
миллиметра.
При недостаточной толщине кости в вестибуло-оральном направлении в Вашем
распоряжении находятся имплантаты типа tioLogic
®
S ø 3,3 мм миллиметра. Из-за
их меньшего диаметра и допускаемой на них нагрузки (по сравнению, например,
с имплантатами типа tioLogic
®
M ø 4,2 мм), ограничины и показания к их применению.
На беззубой челюсти необходимо установить как минимум четыре имплантата типа
tioLogic
®
S ø 3,3 мм для опоры блокированного протеза балочной фиксации без
всяких удленений. При протезировании с опорой на имплантаты челюсти с частич-
ной адентией их следует комбинировать с имплантатами типа tioLogic
®
ø 4,2 мм или
ø4,8мм, или ø5,5мм и необходимо изготовить несъёмные блокированные протезы.
При протезировании отдельными коронками типы имплантатов S ø 3,3 мм использу-
ются только для нижних резцов или верхних латеральных резцов и при этом только
длиной как минимум 11,0 мм. Для протезирования отдельными коронками с опорой
на имплантаты типа tioLogic
®
ø 3,7 мм, ø 4,2 мм, ø 4,8 мм и ø 5,5 мм предусматривается
минимальная длина 9,0 мм. При использовании шаровидных креплений в сочетании с
имплантатами ø 3,3 мм необходимо избегать слишком сильных механических нагрузок
на имплантаты.
4. Противопоказания
Имплантаты ø 3,3 мм запрещено использовать для протезирования отдельных
центральных резцов верхней челюсти, а также клыков, премоляров и моляров как
верхней, так и нижней челюстей. Запрещено устанавливать на эти имплантаты
конструкции с двойными коронками. Если дивергенция на имплантат превышает 10°,
применение абатментов LOCATOR
®
противопоказано.
Общие противопоказания:
Следует учитывать общие противопоказания при стоматологических хирургических
вмешательствах. Среди прочего, к ним относятся: ослабленная иммунная система /
терапия с применением стероидов / нарушения свёртывания крови / неконтролируемые
эндокринные заболевания / ревматические заболевания / заболевания опорно-
двигательного аппарата / цирроз печени / употребление наркотиков, алкоголя или
курение / депрессии, психопатии / недостаточное сотрудничество пациентов / хрониче-
ские воспалительные заболевания.
Локальные противопоказания/индивидуальные противопоказания:
Остеомиелит / Радиотерапия в области головы / Рецидивирующие заболевания
слизистой оболочкиполости рта /Заболеваниявисочно-челюстного сустава/Парафункции/
Вертикальный и горизонтальный дефецит кости, челюстные дефекты, неудовлетвори-
тельное состояние качества костной ткани / не достаточная гигиена полости рта.
5. Дальнейшие указания
Дентальные имплантаты устанавливаются с большим процентом успеха и имеют
продолжительный срок годности. Тем не менее, нет гарантии на успешное лечение.
В таких случаях пользователю следует оценить ситуацию, провести документацию и
проинформировать изготовителя.
Недостаточное число имплантатов, недостаточная длина и диаметр имплантатов,
невыгодное расположение имплантатов, а также неблагоприятная статика протеза
могут под воздействием биомеханической нагрузки привести к усталостному перелому
имплантатов, абатментов, а также ортопедических конструкций и винтов. При установке
имплантатов и изготовлении протеза для предотвращения перегрузки применяемых
компонентов следует учитывать индивидуальную клиническую ситуацию пациентов.
Также использование компонентов системы имплантатов tioLogic
®
, которые согласно
инструкциям по применению /справочникам нельзя друг с другом комбинировать,
может привести к механической проблеме, к повреждению тканей или неудовлетвори-
тельным эстетическим результатам.
Побочные и перекрёстные реакции на имплантаты типа tioLogic
®
неизвестны. Тем не
менее, не исключено, что в редких исключительных случаях могут возникнуть аллергии
на составные элементы применяемых материалов системы имплантатов tioLogic
®
или
неприятные ощущения в полости рта, обусловленные электрохимичeскими процессами.
6. Упаковка и стерильность
Все типы имплантатов tioLogic
®
поставляются в отдельности с соответствующими
винтами-заглушками в двойной упаковке, стерилизованной гамма-лучами (пакет
из плёнки и блистерная упаковка), которая защищает продукцию от контаминации.
Дополнительную защиту для двойной упаковки предоставляет внешняя упаковка.
В случае нарушения целостности двойной упаковки, продукцию нельзя использовать,
так как стерильность содержимого упаковки более не гарантируется. tioLogic
®
имплан-
таты предназначаются исключительно для одноразового применения.
Все другие компоненты системы имплантатов tioLogic
®
поставляются нестерильными.
Хирургические компоненты следует перед употреблением тщательно дезинфицировать,
очистить и стерилизовать. Это также относится в особенности к разборным компонен-
там, как например ключ с моментом затяжки.
7. Применение / Наличие / Меры предосторожности / Документация
Ассортимент продукции tioLogic
®
распространяется только среди врачей, врачей-
стоматологов и зубных техников. Продукцией могут пользоваться только врачи,
врачи-стоматологи и зубные техники, которые имеют опыт работы в области
дентальной имплантологии, включая постановку диагноза, проведение преопера-
тивного планирования, хирургичеcкого и протезно-ортопедического этапа работы.
Пользователь должен перед употреблением удостовериться, что он тщательно про-
читал и понял все инструкции по применению /справочники о tioLogic
®
. Настоящая
краткая инструкция не замещает полные инструкции по пременению/ справочники для
системы имплантатов tioLogic
®
. Так как инструкции по применению / справочники не
могут поставлять всю нужную информацию для непосредственного применения, ле-
чащему пользователю настойчиво рекомендуется перед применением посетить курсы
повышения квалификации, предлагаемые Dentaurum Implants, чтобы полностью озна-
комиться с системой tioLogic
®
.
В отношении мер предосторожности и выбора компонентов на клиническом этапе
работы рекомендуется ознакомиться с каталогом продукции и со «Справочниками
по хирургии».
В отношении мер предосторожности и выбора компонентов на ортопедическом
этапе работы рекомендуется ознакомиться с каталогом продукции и со
«Справочниками по ортопедической стоматологии».
Перед тем, как применять эту продукцию пользователь обязан подробно обследовать
и проконсультировать пациента. Фирма Dentaurum Implants рекомендует вести полную
клиническую, фотографическую и статистическую документацию, а также документацию
рентгеновских снимков. При документации компонентов системы имплантатов
tioLogic
®
могут использоваться дополнительные этикетки, например, в истории
болезни пациента или в медицинском паспорте пациента. При интраоральном
применении продукции защиту от аспирации обеспечивает пользователь.
Не все компоненты находятся в распоряжении во всех странах.
8. Качество / Гарантия и ответственность / Дальшейшая разработка
Дальнейшая разработка, клиническая проверка, изготовление и сохранение качества
программы продукции tioLogic
®
осуществляются согласно требованиям директивы
93/42/EWG, решающей для медицинской продукции.
В случае гарантии и приёма ответственности – кроме описанных в этом кратком
описании исключений – основополагающими являются пункты 9 и 10 наших общих
условий по поставкам и платежу.
Гарантия и ответственность исключаются особенно в случае ненадлежащего
использования продукции пользователем или третьим лицом; это также относится
к случаям, когда программа продукции tioLogic
®
комбинируется с продукцией других
изготовителей, применение которой не было категорически рекомендовано
Dentaurum Implants.
Обработка и применение продукции не контролируются Dentaurum Implants и
подподают исключительно под ответственность пользователя.
Техническая рекомендация по пользованию (устная и письменная) проводится согласно
актуальному уровню развития науки и техники, которые известны на момент
изготовления продукции.
Это не освобождает пользователя от обязанности самому проверять пригодность
продукции для предусмотренных показаний и применений. При этом они являются
лишь общими рекомендациями, из которых не могут исходить никакие обещания или
предоставление гарантий.
Вся продукция подвергается дальшейшей разработке с учётом соответствующего
актуального уровня научных достижений – мы оставляем за собой право делать
изменения в конструкции, дизайне и материале.
9. Объяснение применяемых знаков на этикетке
Учитывайте, пожалуйста, данные на этикетке. С дополнительной
информацией вы можете ознакомиться в интернете на сайте
www.dentaurum-implants.com (разъяснение знаков на этикетке
REF 989-313-00).
989-701-27 Printed by Dentaurum Germany 05/17/C/R1-10
Kurzanweisung für das tioLogic® Implantatsystem
Quick reference guide to the tioLogic
®
implant system
Notice informative concernant le système d’implants tioLogic
®
Instrucciones abreviadas para el sistema de implantes tioLogic
®
Brevi istruzioni per l‘uso per il sistema d‘impianti tioLogic
®
Краткая инструкция для системы
имплантатов tioLogic®
Turnstr. 31 I 75228 Ispringen I Germany I Tel. + 4972 31 /803- 0 I Fax + 49 7231/ 803 -295
www.dentaurum-implants.com I info@dentaurum-implants.com
Informationen zu Produkten finden Sie
unter www.dentaurum-implants.com
For more information on our products,
please visit www.dentaurum-implants.com
Vous trouverez toutes les informations sur nos produits
sur www.dentaurum-implants.com
Descubra nuestros productos en www.dentaurum-implants.com
Informazioni su prodotti sono disponibili nel sito
www.dentaurum-implants.com
Вы можете ознакомиться с информацией о продуктах
на сайте www.dentaurum-implants.com
Stand der Information I Date of information I
Mise à jour I Fecha de la información I
Data dell‘informazione I
Статус информации
: 05/17
Änderungen vorbehalten I Subject to modifications I Sous réserve
de modifications I Reservado el derecho de modificación I
Con riserva di apportare modifiche I
Изменения возможны
IN