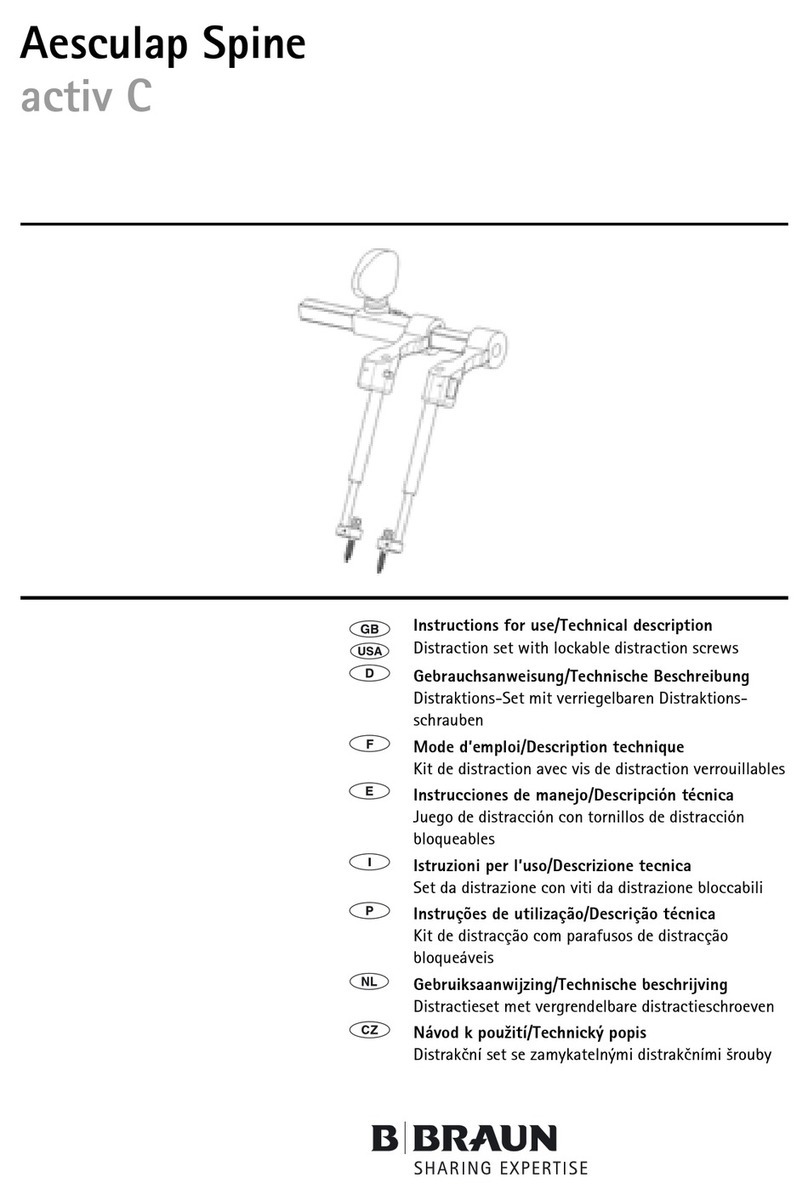
Aesculap®
Instrument d’insertion PROSPACE® PEEK SN002R
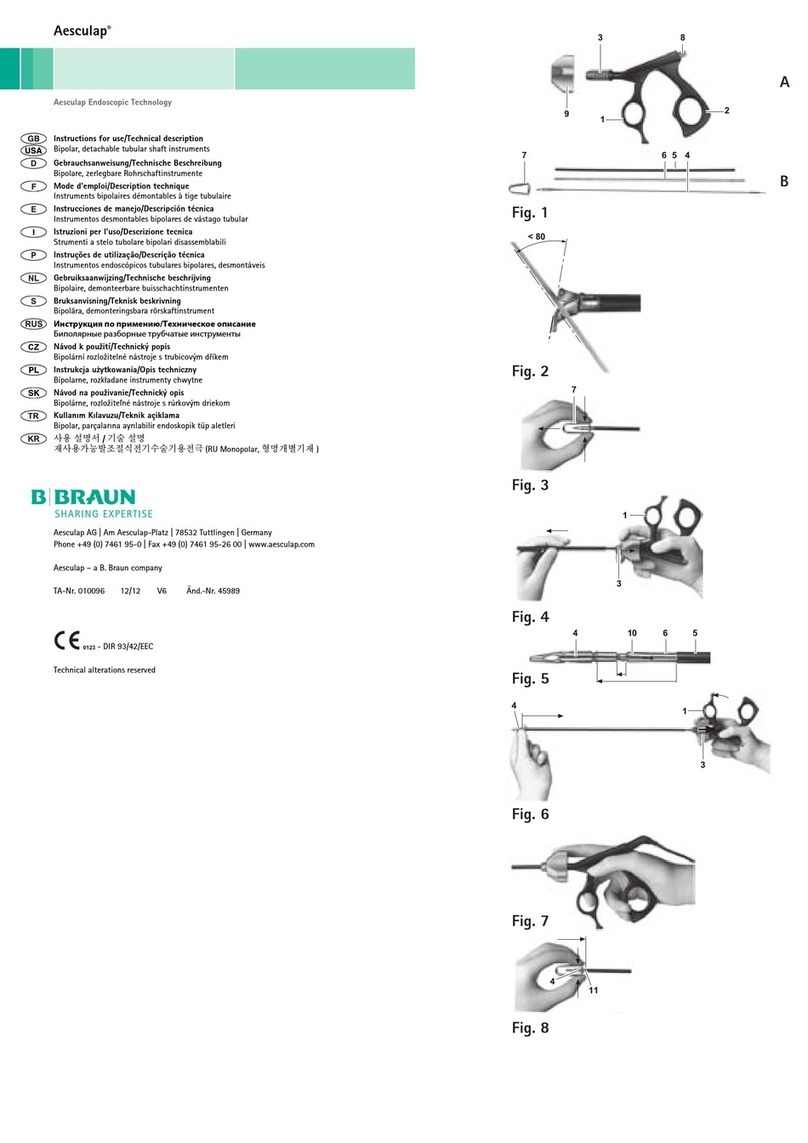
Légende
1Raccord
2Pince de blocage
3Tube
4Bouton rotatif
Symboles sur le produit et emballage
Domaine d'application
►Pour obtenir le mode d’emploi d’un article ou des informations sur la compatibilité des matériaux, voir aussi
l’extranet d’Aesculap à l’adresse suivante: www.extranet.bbraun.com
Champ d’application
L’instrument d’insertion PROSPACE® PEEK SN002R s’utilise pour l’implantation des implants PROSPACE® PEEK dans
l’espace intervertébral du rachis lombaire.
Manipulation sûre et préparation
►Confier le fonctionnement et l’utilisation du produit et des accessoires uniquement à des personnes disposant de
la formation, des connaissances ou de l’expérience requises.
►Lire, observer et conserver le mode d’emploi.
►Utiliser le produit uniquement pour les fins prévues, voir Champ d’application.
►Nettoyer (à la main ou en machine) le produit neuf sortant d’usine après le retrait du conditionnement de trans-
port et avant la première stérilisation.
►Conserver le produit neuf ou non utilisé dans un endroit sec, propre et protégé.
►Avant chaque utilisation, procéder à un examen visuel du produit: absence de pièces lâches, tordues, brisées, fis-
surées, usées et rompues.
►Ne jamais utiliser un produit endommagé ou défectueux. Mettre immédiatement au rebut le produit endommagé.
►Remplacer immédiatement les pièces défectueuses par des pièces de rechange d’origine.
Manipulation
►Monter la pince de blocage 2et ouvrir l’instrument d’insertion PROSPACE® PEEK SN002R au maximum, voir
Montage.
►Placer l’implant choisi sur le raccord 1de la pince de blocage 2.
►Tourner le bouton rotatif 4dans le sens des aiguilles d’une montre jusqu’à ce que l’implant soit solidement fixé.
Ce faisant, s’assurer que les broches du raccord 1de la pince de blocage 2s’engagent dans les sections arrière
de l’implant.
►Présenter l’implant dans le compartiment du disque intervertébral préparé.
►Tourner le bouton rotatif 4dans le sens contraire des aiguilles d’une montre jusqu’à ce que les deux flèches du
marquage soient l’une au-dessus de l’autre, voir Fig. 4.
►Détacher l’implant de l’instrument d’insertion PROSPACE® PEEK SN002R.
►Retirer l’instrument d’insertion PROSPACE® PEEK SN002R avec précautions dans le sens de l’axe longitudinal de
l’implant.
Démontage
►Tourner le bouton rotatif 4dans le sens contraire des aiguilles d’une montre jusqu’à ce que la pince de blocage 2
soit desserrée.
►Retirer la pince de blocage 2du tube 3dans le sens de la flèche, voir Fig. 1.
Montage
►Introduire la pince de blocage 2à fond dans le tube 3dans le sens de la flèche, voir Fig. 2. Veiller ce faisant à
aligner correctement la rainure de la pince de blocage 2sur les broches d’écartement dans le tube 3, voir Fig. 3.
►En arrivant en butée, continuer à presser la pince de blocage 2dans le sens de la flèche et tourner le bouton
rotatif 4dans le sens des aiguilles d’une montre jusqu’à ce que les flèches de marquage soient l’une au-dessus
de l’autre, voir Fig. 4.
La position d’ouverture maximale de l’instrument d’insertion PROSPACE® PEEK SN002R est atteinte.
Procédé de traitement stérile validé
Consignes générales de sécurité
Remarque
En matière de traitement stérile, respecter les prescriptions légales nationales, les normes et directives nationales et
internationales ainsi que les propres dispositions relatives à l’hygiène.
Remarque
Pour les patients atteints de la maladie de Creutzfeldt-Jakob (CJ), soupçonnés d’être atteints de CJ ou d’éventuelles
variantes, respecter les réglementations nationales en vigueur pour la préparation stérile des produits.
Remarque
Le traitement stérile en machine doit être préféré au nettoyage manuel du fait de résultats de nettoyage meilleurs et
plus fiables.
Remarque
On notera que la réussite du traitement stérile de ce produit médical ne peut être garantie qu’après validation préa-
lable du procédé de traitement stérile. La responsabilité en incombe à l’exploitant/au responsable du traitement sté-
rile.
Pour la validation, les produits chimiques recommandés ont été utilisés.
Remarque
Si aucune stérilisation finale n'a lieu, des produits de décontamination virocides doivent être utilisés.
Remarque
Pour des informations actuelles sur le traitement stérile et la compatibilité avec les matériaux, voir également l'Extra-
net Aesculap à l'adresse www.extranet.bbraun.com
Le procédé validé de stérilisation à la vapeur a été réalisé dans le système de conteneurs stériles Aesculap.
Remarques générales
Les résidus opératoires incrustés ou fixés peuvent faire obstacle au nettoyage ou le rendre inefficace et entraîner
une corrosion. Un intervalle de 6 h entre utilisation et traitement stérile ne devrait par conséquent pas être dépassé,
de même qu’il ne faut pas appliquer de températures de prélavage fixantes >45 °C ni utiliser de produits désinfec-
tants fixants (substance active: aldéhyde, alcool).
Un surdosage du produit de neutralisation ou du détergent de base peut entraîner une agression chimique et/ou le
palissement et l’illisibilité visuelle ou mécanique de l’inscription laser sur l’acier inoxydable.
Sur l’acier inoxydable, les résidus contenant du chlore ou des chlorures (p. ex. les résidus opératoires, médicaments,
solutions salines, eau pour le nettoyage, la décontamination et la stérilisation) entraînent des dégâts dus à la corro-
sion (corrosion perforatrice, sous contrainte) et donc la dégradation des produits. Les résidus sont éliminés par rin-
çage suffisamment abondant à l’eau déminéralisée et séchage consécutif.
Sécher ensuite si nécessaire.
Seuls doivent être utilisés des produits chimiques de traitement contrôlés et validés (p. ex. agrément VAH ou FDA ou
marquage CE) et recommandés par le fabricant des produits chimiques quant à la compatibilité avec les matériaux.
Toutes les prescriptions d’application du fabricant des produits chimiques doivent être strictement respectées. Dans
le cas contraire, les problèmes suivants peuvent survenir:
■Modification d’aspect du matériau, p. ex. palissement ou altérations de couleur du titane ou de l’aluminium. Sur
l’aluminium, des altérations de surface visibles peuvent se produire dès une valeur de pH de >8 dans la solution
utilisée.
■Détériorations de matériau telles que corrosion, fissures, cassures, vieillissement prématuré ou dilatations.
►Pour le nettoyage, ne pas utiliser de brosses métalliques, ni d’autres produits abrasifs pouvant abîmer la surface,
faute de quoi il y a risque de corrosion.
►Pour des informations plus détaillées sur un retraitement hygiéniquement sûr qui ménage les matériaux et
conserve leur valeur aux produits, consulter www.a-k-i.org à la rubrique “Veröffentlichungen Rote Broschüre” -
Le traitement correct des instruments de chirurgie.
Démontage avant l'application du procédé de traitement
►Démonter le produit immédiatement après usage suivant les instructions.
Préparation sur le lieu d’utilisation
►Le cas échéant, rincer les surfaces non visibles, de préférence avec de l'eau déminéralisée, par exemple à l'aide
d'une seringue à usage unique.
►Retirer si possible complètement les résidus opératoires visibles avec un chiffon humide non pelucheux.
►Pour le nettoyage et la décontamination, transporter le produit sec dans un container d’élimination des déchets
fermé dans un délai de 6 h.
Préparation avant le nettoyage
►Démonter le produit avant le nettoyage, voir Démontage.
Nettoyage/décontamination
Consignes de sécurité spécifiques du produit pour le procédé de traitement
►Ne pas utiliser de produits chimiques oxydants pour le nettoyage en machine (p. ex. H2O2) car ils peuvent pro-
voquer un palissement ou une destruction de couches superficielles.
►En cas d’évacuation à l’état humide, utiliser un produit de nettoyage/décontamination adéquat. Pour éviter la
formation de mousse et une dégradation de l’efficacité des produits chimiques de traitement: avant le nettoyage
et la décontamination en machine, rincer abondamment le produit à l’eau courante.
►Procéder au nettoyage aux ultrasons:
– comme nettoyage consécutif de produits présentant des résidus non éliminés après le nettoyage/la déconta-
mination en machine.
Procédé de nettoyage et de décontamination validé
Attention, symbole général de mise en garde
Attention, tenir compte des documents d’accompagnement
Date de fabrication
AVERTISSEMENT
Risque de blessure et/ou de dysfonctionnement!
►Procéder à un contrôle du fonctionnement avant chaque utilisation.
AVERTISSEMENT
Risque de blessure en cas d’utilisation du produit en dehors du champ de visibilité!
►Utiliser le produit uniquement sous contrôle visuel.
ATTENTION
Risque de détérioration du produit avec un produit de nettoyage/décontamination
inadéquat et/ou des températures trop élevées!
►Utiliser en respectant les instructions du fabricant des produits de nettoyage
et de décontamination
–agréés (p. ex. pour l’aluminium, les plastiques, l’acier inoxydable),
–qui n’attaquent pas les plastifiants (p. ex. en silicone).
►Respecter les indications sur la concentration, la température et le temps
d’action.
►Ne pas dépasser la température de nettoyage maximale autorisée de 60 °C.
Procédé validé Particularités Réf. dorsale
Nettoyage préalable manuel à la
brosse suivi du nettoyage alcalin en
machine et de la désinfection ther-
mique
■Brosse de nettoyage adaptée
■Seringue à usage unique de
20 ml
■Placer la protection des mors
sur le produit.
■Poser le produit dans un panier
perforé convenant au net-
toyage (éviter les zones sans
contact avec la solution).
■Raccorder directement les
pièces avec lumières et canaux
au raccord d’irrigation spécial
du chariot à injection.
■Laisser les extrémités de travail
ouvertes pour le nettoyage.
■Poser le produit avec articula-
tion ouverte dans le panier per-
foré.
Chapitre Nettoyage/décontamina-
tion en machine avec nettoyage
préalable manuel et sous-chapitre:
■Chapitre Nettoyage préalable
manuel à la brosse
■Chapitre Nettoyage alcalin en
machine et décontamination
thermique