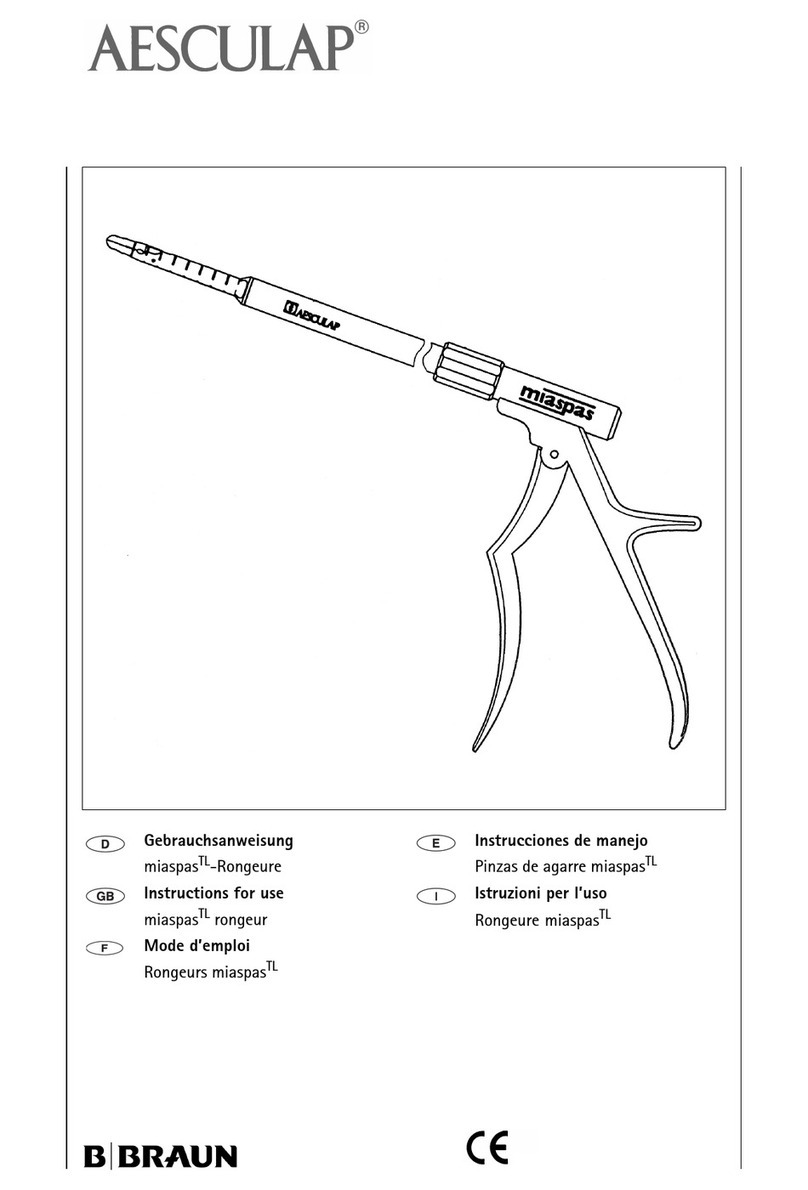
es
AESCULAP®
Filtro reutilizable
1. Sobre el presente documento
1.1 Ámbito de aplicación
Estas instrucciones de uso se aplican a los filtros reutilizables JK089, JK090, JK091 y JK092.
►Para ver las instrucciones de uso específicas de los artículos, así como la información sobre la compatibilidad de
materiales y la vida útil del producto, consulte B. Braun eIFU en eifu.bbraun.com
1.2 Advertencias
Las advertencias avisan de los peligros para el paciente, el usuario y el producto que pueden surgir durante el uso
del producto. Las advertencias están marcadas de la siguiente forma:
ADVERTENCIA
Indica un posible riesgo. Si no se evita, pueden producirse lesiones de leves a medias.
ATENCIÓN
Indica un posible daño material. Si no se evita, el producto podría sufrir daños.
2. Uso clínico
2.1 Ámbitos de aplicación y limitación de uso
2.1.1 Uso previsto
El filtro reutilizable se utiliza en los contenedores estériles de Aesculap como barrera contra los gérmenes. Los filtros
hidrófobos de PTFE pueden utilizarse para la esterilización a vapor en un esterilizador según DIN EN 285 mediante
un método de vacío fraccionado validado según DIN EN ISO 17665. Los filtros pueden permanecer en la tapa durante
la limpieza automática y son aptos para 1.000 ciclos de esterilización y lavado.
2.1.2 Indicaciones
Nota
El fabricante no se hace responsable de un uso del producto contrario a las indicaciones mencionadas y/o las aplica-
ciones descritas.
Para las indicaciones, ver Uso previsto.
2.1.3 Contraindicaciones
No se conocen contraindicaciones.
2.2 Advertencias de seguridad
2.2.1 Usuarios clínicos
Advertencias de seguridad generales
Para evitar daños causados por un tratamiento y uso inadecuados y conservar así los derechos de garantía y respon-
sabilidad del fabricante:
►Utilizar el producto sólo conforme a las presentes instrucciones de uso.
►Respetar la información sobre las medidas de seguridad y las instrucciones de mantenimiento.
►La aplicación y el uso del producto y de los accesorios debe confiarse exclusivamente a personal con la formación
requerida para ello o que disponga de los conocimientos y experiencia necesarios.
►Conservar el producto nuevo de fábrica o no utilizado aún en un lugar seco, limpio y protegido.
►Antes de utilizar el producto, comprobar que funcione y que se encuentre en perfecto estado.
►Conservar las instrucciones en un lugar accesible para el operario.
Nota
El usuario está obligado a notificar al fabricante y a las autoridades competentes del país todos los incidentes graves
relacionados con el producto en los que se vea implicado.
Observaciones sobre intervenciones quirúrgicas
Será el especialista médico el que decida acera de la aplicabilidad concreta en función de las propiedades garanti-
zadas y los datos técnicos.
2.2.2 Esterilidad
El producto se suministra sin esterilizar.
►Limpiar bien el producto nuevo de fábrica después de haberlo desembalado y antes de la primera esterilización.
2.3 Aplicación
ADVERTENCIA
Peligro de lesiones y/o fallos de funcionamiento.
►Antes de cada utilización, sacar el filtro reutilizables e inspeccionar el producto visualmente en busca de
piezas sueltas, dobladas, rotas, agrietadas o desgastadas.
►Comprobar el funcionamiento antes de cada uso.
►Fijar el filtro reutilizable en el contenedor estéril con la ayuda del correspondiente soporte para filtros.
►Si se utiliza el filtro redondo (JK090), comprobar que el soporte para filtros es el adecuado (TE674/JK100).
►Asegurarse de que el filtro no se dobla al colocarlo.
►Cuando se utilice el filtro por primera vez, anotar en la lengüeta el inicio y el fin de uso del filtro (equivalente a
1.000 ciclos) con un rotulador apropiado.
Fig.1 Anotar el inicio de uso
Fig.2 Anotar el final del uso
►Una vez agotada la vida útil del filtro deberá cambiarse por otro.
3. Proceso homologado del tratamiento de instrumental quirúrgico
3.1 Advertencias de seguridad generales
Nota
Cumplir las disposiciones legales y las normas y directrices nacionales e internacionales, además de las normas higié-
nicas del centro donde se va a llevar a cabo el tratamiento de los productos.
Nota
En el caso de pacientes que padezcan la enfermedad de Creutzfeldt-Jakob, o con sospecha de padecer dicha enferme-
dad o sus variantes, deberá cumplirse la normativa vigente del país en cada caso con respecto al tratamiento de los
productos.
Nota
Se dará preferencia al tratamiento automático frente a la limpieza manual, ya que se obtiene un resultado más seguro
y eficaz.
Nota
Deberá tenerse en cuenta que la correcta limpieza de este producto sanitario sólo podrá ser garantizada mediante una
validación previa del proceso de tratamiento. La responsabilidad corresponde al usuario/preparador.
Nota
Para consultar información actualizada sobre cómo preparar los productos y sobre la compatibilidad de materiales,
visite también B. Braun eIFU en eifu.bbraun.com
El método homologado de esterilización a vapor se ha realizado en el sistema de contenedores estériles de Aesculap.
3.2 Indicaciones generales
Los residuos resecos o incrustados de intervenciones quirúrgicas pueden dificultar la limpieza o hacerla ineficaz. Por
esa razón, no deberían transcurrir más de 6 horas entre el uso y la limpieza de los mismos, ni deberían emplearse
temperaturas de prelavado superiores a >45 °C, ni usarse desinfectantes con fijador (con principios activos base de
aldehído) que puedan favorecer la incrustación.
Para eliminar cualquier resto, deberán aclararse a fondo los productos con agua completamente desmineralizada,
secándolos a continuación.
Efectuar un secado final, si es necesario.
Se deben utilizar únicamente productos químicos de proceso comprobado y autorizado (p. ej., autorizados por
VAH/DGHM o la FDA, o con marcado CE), y recomendados por el fabricante en cuanto a su compatibilidad con el
material. Deberán cumplirse estrictamente todas las instrucciones del fabricante para el producto químico.
►No limpiar nunca la superficie con cepillos metálicos u otros medios abrasivos.
3.3 Productos reutilizables
Se desconocen los factores que pueden provocar daños en el producto derivados de su procesamiento.
Para detectar que el producto no funciona, se aconseja, antes del primer uso, llevar a cabo un examen visual y fun-
cional, ver Inspección.
3.4 Advertencias específicas de seguridad a la hora de realizar el proceso de tra-
tamiento
Nota
Aesculap recomienda efectuar una limpieza automática de los filtros montados.
Si se limpian los filtros una vez desmontados:
►Al extraer el filtro redondo JK090 asegurarse de que el orificio del centro no resulta dañado.
►Asegurarse de que el filtro no resulte dañado durante la limpieza, por ejemplo a causa de los instrumentos junto
a los que se limpie.
►Limpiar el filtro desmontado y por separado.
3.5 Limpieza/Desinfección manuales
ATENCIÓN
El filtro puede dañarse si se realiza una limpieza manual.
►Efectuar una limpieza lo más automática posible de los filtros montados.
►Para la limpieza utilizar únicamente los productos utilizados en el hospital para los instrumentos y conte-
nedores estériles.
►Antes de proceder a la desinfección manual, dejar escurrir primero los restos del agua de irrigación con el fin de
evitar luego que el desinfectante se diluya.
►Después de la limpieza/desinfección manuales, comprobar visualmente que no han quedado restos en las super-
ficies visibles.
►Si fuera necesario, repetir el proceso de limpieza/desinfección o, en caso necesario, procesar el filtro reutilizable
automáticamente.
3.5.1 Limpieza manual y desinfección con un paño
AP: Agua potable
A–CD: Agua completamente destilada (desmineralizada y desde el punto de vista microbiológico, con
calidad de agua potable, como mínimo)
TA: Temperatura ambiente
Fase I
►Lavar el producto bajo un chorro de agua corriente y utilizar un cepillo de limpieza adecuado hasta eliminar todos
los restos de la superficie.
Fase II
►Secar el producto durante la Fase de secado con toallitas o con aire comprimido de uso médico.
Fase III
►Limpiar el producto a fondo con un paño de desinfección de un solo uso.
Fase IV
►Una vez finalizado el tiempo de actuación estipulado (al menos 1 minuto), aclarar las superficies desinfectadas
con agua corriente completamente desmineralizada.
►Dejar que el agua restante se escurra lo suficiente.
Fase V
►Secar el producto durante la Fase de secado con toallitas o con aire comprimido de uso médico.
Fase Paso T
[°C/°F]
t
[min]
Conc.
[%] Calidad
del agua Sust. químicas
I Limpieza TA (frío) - - AP -
II Secado TA - - - -
III Desinfección por frota-
miento - >1 - - Toallitas Meliseptol HBV
50 % Propan-1-ol
IV Aclarado final TA (frío) 0,5 - A–CD -
VSecado TA - - - -